题目内容
确定某溶液中含有SO42-,下列方案中正确的是
A.先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解
B.先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀
C.先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀
D.先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀
练习册系列答案
相关题目
8. 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
(1)写出W的原子结构示意图: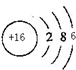 .
.
(2)已知:
①X(s)+O2(g)=XO2(g)△H=-393.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1
③XH4(g)+2O2(g)=XO2(g)+2H2O(g)△H=-802.0kJ•mol-1
则XH4气体分解成氢气和X固体的热化学方程式为CH4(g)=2H2(g)+C(s)△H=+75.5kJ/mol.
(3)ZO是由单质X和ZO2反应制取单质Z的中间产物(空气中极不稳定).隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O.
(4)元素Y的Ca盐和H2为原料,反应产物只有甲和乙两种且均为化合物.研究发现:化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性.则乙的化学式为HCl;甲与水反应可得H2,其化学方程式是:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑.
(5)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为NaOH、Na2S.
②a点溶液中,c(Na+):c(Cl-)=5:3.
 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.| X | |||
| Z | W | Y |
 .
.(2)已知:
①X(s)+O2(g)=XO2(g)△H=-393.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-242.0kJ•mol-1
③XH4(g)+2O2(g)=XO2(g)+2H2O(g)△H=-802.0kJ•mol-1
则XH4气体分解成氢气和X固体的热化学方程式为CH4(g)=2H2(g)+C(s)△H=+75.5kJ/mol.
(3)ZO是由单质X和ZO2反应制取单质Z的中间产物(空气中极不稳定).隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O.
(4)元素Y的Ca盐和H2为原料,反应产物只有甲和乙两种且均为化合物.研究发现:化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性.则乙的化学式为HCl;甲与水反应可得H2,其化学方程式是:2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑.
(5)将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为NaOH、Na2S.
②a点溶液中,c(Na+):c(Cl-)=5:3.
9.甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低.能说明甲比乙的得电子能力强的是( )
| A. | ④ | B. | ⑤ | C. | ①②③ | D. | ①②③④ |
13.有机物分子中原子(或原子团)间的相互影响会导致化学性质的不同.下列叙述能说明上述观点的是( )
| A. | 苯酚和乙酸都能与NaOH溶液反应 | |
| B. | 甲酸可发生银镜反应,而乙酸不能 | |
| C. | 苯酚能与氢氧化钠溶液反应 而乙醇不行 | |
| D. | 乙烯可发生加成反应,而乙烷不能 |
7.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗.正确的操作顺序是( )
| A. | ①②③④⑤ | B. | ②④②③① | C. | ④②③① | D. | ②④①③ |
4.在滴加合成洗涤剂的H2O2的水溶液中,加入下列物质时,能使实验现象更明显的是( )
| A. | 稀H2SO4 | B. | NaOH溶液 | C. | MnO2 | D. | CaO |


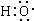
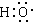 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

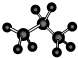
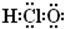
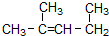 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯 )一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
)一定温度下,在2L的密闭容器中,SO2、O2、SO3三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题: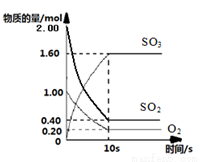
 2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。
2SO3(g),当反应达到平衡时,如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= ;υ(SO3)= 。 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1