题目内容
14.元素金属性的强弱,可以从它的单质与水或酸反应置换氢的反应程度,以及它的最高价氧化物的水化物的碱性强弱来判断.元素非金属性的强弱,可以从它的最高价氧化物的水化物的酸性强弱,或它的单质跟H2生成气态氢化物的难易程度及氢化物的稳定性来判断.分析 元素的金属性越强,其单质与水或酸反应越剧烈,其最高价氧化物的水化物碱性越强;元素的非金属性越强,其最高价氧化物的水化物酸性越强、其单质与氢气化合越容易,其氢化物的稳定性越强,据此分析解答.
解答 解:元素的金属性越强,其单质的还原性越强,所以其单质与水或酸反应越剧烈,其最高价氧化物的水化物碱性越强;元素的非金属性越强,其最高价氧化物的水化物酸性越强,其单质的氧化性越强,所以其单质与氢气化合越容易,其简单阴离子的还原性越弱,所以其氢化物的稳定性越强,
故答案为:反应;碱性;酸性;难易程度;稳定性.
点评 本题考查元素金属性和非金属性元素周期律,为高频考点,明确金属性、非金属性强弱判断方法是解本题关键,不能根据得失电子多少判断金属性、非金属性强弱,要根据其得失电子难易程度判断,题目难度不大.

练习册系列答案
相关题目
5.在pH=13的无色溶液中,可以大量共存的一组离子是( )
| A. | NH4+、NO3-、K+、SO42- | B. | CO32-、NO3-、HCO3-、Na+ | ||
| C. | Na+、ClO-、AlO2-、NO3- | D. | Cu2+、K+、Na+、SO42- |
9.甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低.能说明甲比乙的得电子能力强的是( )
| A. | ④ | B. | ⑤ | C. | ①②③ | D. | ①②③④ |
19.A、B、C三种元素的原子核外具有相同的电子层数,其最高价氧化物对应水化物的酸性强弱顺序是 HAO4>H2BO4>H3CO4,则下列判断中错误的是( )
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
1.下列有关物质结构的说法正确的是( )
| A. | 1molH2O含有2mol氧元素 | |
| B. | 1.8gNH4+中含有的质子数为NA | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和HCl分子中所有原子的最外层都达到8电子稳定结构 |
 (1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.
(1)机动车尾气和燃烧产生的烟气含氮的氧化物,可以用CH4催化还原NOx消除氮氧化物的污染.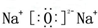 .F的原子结构示意图为
.F的原子结构示意图为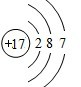 .
.
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同



 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯