��Ŀ����
17����֪����Cl2ͨ������KOH��Һ�������п�����KCl��KClO��KClO3����$\frac{c��C{1}^{-}��}{c��C1{O}^{-}��}$��ֵ���¶ȸߵ��йأ���n��KOH��=a molʱ�������й�˵��������ǣ�������| A�� | ��ij�¶��£���Ӧ��$\frac{c��Cl-��}{c��ClO-��}$=2������Һ��$\frac{c��C1{O}^{-}��}{c��C1{O}_{3}^{-}��}$=5 | |
| B�� | �μӷ�Ӧ�����������ʵ�������$\frac{1}{2}$ a mol | |
| C�� | �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��$\frac{1}{2}$ a mol��ne��$\frac{5}{6}$ a mol | |
| D�� | �ı��¶ȣ�������KClO3��������۲���Ϊ$\frac{1}{7}$a mol |
���� A����n��ClO-��=1mol����n��Cl-��=2mol�����ݵ���ת���غ����n��ClO3-����
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH������������μӷ�Ӧ���������ʵ�����
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬���ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ�n��KCl��=n��KClO�������ݼ������غ㣺n��KCl��+n��KClO��=n��KOH������������ת�Ƶ������ʵ�����Χ��
D����������ֻ��KClO3ʱ�������ʵ�������ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������ϵ���ת���غ���㣮
��� �⣺A����n��ClO-��=1mol����Ӧ��$\frac{c��C{1}^{-}��}{c��C1{O}^{-}��}$=2����n��Cl-��=2mol������ת���غ㣬5��n��ClO3-��+1��n��ClO-��=1��n��Cl-������5��n��ClO3-��+1��1mol=1��2mol�����n��ClO3-��=0.2mol������Һ��$\frac{c��C1{O}^{-}��}{c��C1{O}_{3}^{-}��}$=5����A��ȷ��
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH�����ʲμӷ�Ӧ�����������ʵ���=$\frac{1}{2}$n��KOH��=0.5amol����B��ȷ��
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬���ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������n��KClO3��=$\frac{1}{6}$n��KOH��=$\frac{1}{6}$a mol��ת�Ƶ���������ʵ���Ϊ��$\frac{1}{6}$a mol��5=$\frac{5}{6}$a mol��
��������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ�n��KCl��=n��KClO�������ݼ������غ㣺n��KCl��+n��KClO��=n��KOH�����ʣ�n��KClO��=$\frac{1}{2}$n��KOH��=$\frac{1}{2}$a mol��ת�Ƶ�����С���ʵ���=$\frac{1}{2}$a mol��1=$\frac{1}{2}$a mol����Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�ΧΪ$\frac{1}{2}$ a mol��ne��$\frac{5}{6}$ a mol����C��ȷ��
D����������ֻ��KClO3ʱ�������ʵ�������ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������n�����KClO3��=��=$\frac{1}{6}$n��KOH��=$\frac{1}{6}$a mol����D����
��ѡD��
���� ���⿼��������ԭ��Ӧ���㣬Ϊ��Ƶ���㣬ע�����ת���غ㼰������Ӧ�ã����ؿ���ѧ������������������Ŀ�Ѷ��еȣ�

 ������Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ��ʾ������W�����������γ��������Ҫ����֮һ��
������Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ��ʾ������W�����������γ��������Ҫ����֮һ��| X | |||
| Z | W | Y |
 ��
����2����֪��
��X��s��+O2��g��=XO2��g����H=-393.5kJ•mol-1
��H2��g��+$\frac{1}{2}$O2��g��=H2O��g����H=-242.0kJ•mol-1
��XH4��g��+2O2��g��=XO2��g��+2H2O��g����H=-802.0kJ•mol-1
��XH4����ֽ��������X������Ȼ�ѧ����ʽΪCH4��g��=2H2��g��+C��s����H=+75.5kJ/mol��
��3��ZO���ɵ���X��ZO2��Ӧ��ȡ����Z���м��������м����ȶ�������������ʱ��ZO��NaOH��Һ��Ӧ�����ﺬ��һ�ֹ��嵥�ʺ�һ�����Σ��Ļ�ѧ����ʽΪ2SiO+2NaOH=Si+Na2SiO3+H2O��
��4��Ԫ��Y��Ca�κ�H2Ϊԭ�ϣ���Ӧ����ֻ�м��������Ҿ�Ϊ������о����֣������������иơ�Ԫ��Y�����������ֱ�Ϊ52.29%��46.41%���������ҵ�ˮ��Һ�����ԣ����ҵĻ�ѧʽΪHCl������ˮ��Ӧ�ɵ�H2���仯ѧ����ʽ�ǣ�2CaHCl+2H2O=CaCl2+Ca��OH��2+2H2����
��5����W����̬�⻯��ͨ��һ������NaOH��Һ�У���������Һ����μ���ϡ����������������������HCl�����ʵ����Ĺ�ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ�����
��O����Һ���������ʵĻ�ѧʽΪNaOH��Na2S��
��a����Һ�У�c��Na+����c��Cl-��=5��3��
| A�� | NH4+��NO3-��K+��SO42- | B�� | CO32-��NO3-��HCO3-��Na+ | ||
| C�� | Na+��ClO-��AlO2-��NO3- | D�� | Cu2+��K+��Na+��SO42- |
| A�� | ȫ���ɷǽ���Ԫ����ɵĻ�������ֻ�����ۼ� | |
| B�� | ͬһ����Ԫ�صĵ����۵���ϵ����������� | |
| C�� | ij��Ԫ�ص����ԭ������ȡ������������������ | |
| D�� | �ڢ�A��Ԫ�ص������ӻ�ԭ������ԭ�������ĵ�������ǿ |
| A�� | �� | B�� | �� | C�� | �٢ڢ� | D�� | �٢ڢۢ� |
| A�� | ϡH2SO4 | B�� | NaOH��Һ | C�� | MnO2 | D�� | CaO |
 ��ͼΪij�¶��£�CuS��s����ZnS��s����FeS��s���ֱ�����Һ�дﵽ�����ܽ�ƽ�����Һ��S2-Ũ�ȣ�����������Ũ�ȱ仯�����������������ֳ����Ļ�����м����ᣬ�����ܽ����FeS��
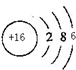
��ͼΪij�¶��£�CuS��s����ZnS��s����FeS��s���ֱ�����Һ�дﵽ�����ܽ�ƽ�����Һ��S2-Ũ�ȣ�����������Ũ�ȱ仯�����������������ֳ����Ļ�����м����ᣬ�����ܽ����FeS��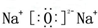 ��F��ԭ�ӽṹʾ��ͼΪ
��F��ԭ�ӽṹʾ��ͼΪ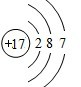 ��
��
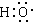 ���Ԫ����ͬ�����еĵ�����Ҳ��ͬ
���Ԫ����ͬ�����еĵ�����Ҳ��ͬ

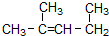 ����Ϊ1��3-����-2-��ϩ
����Ϊ1��3-����-2-��ϩ