题目内容
15.下列关于平衡常数的说法中,正确的是( )| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
分析 平衡常数为生成物、反应物的浓度幂之积的比值,为温度的函数,只受温度的影响,可用于表示反应的程度,一般来说,平衡常数越大,反应的程度越大,以此解答该题.
解答 解:A.反应物和生物物的浓度均为平衡浓度,故A错误;
B.K值受温度的影响,故B错误;
C.只与化学反应本身及外界因素温度有关.不受其它外界条件,如浓度、压强、催化剂等的影响,故C正确;
D.改变压强,平衡常数一定不变,故D错误.
故选C.
点评 本题考查化学平衡常数,为高频考点,本题注意化学平衡常数与浓度、压强、催化剂无关,为易错点,试题培养了学生的灵活应用基础知识的能力,难度不大.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
3.下列实验室制取物质的思路既合理又符合绿色化学思想的是( )
| A. | 制取CuSO4:Cu$\stackrel{浓H_{2}SO_{4}、△}{→}$CuSO4 | |
| B. | 制取Cu(NO3)2:Cu$\stackrel{O_{2}、△}{→}$ $\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| C. | 制取Al(OH)3:Al$\stackrel{NaOH}{→}$ $\stackrel{H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 制取Na2CO3:Na$\stackrel{O_{2}}{→}$ $\stackrel{CO_{2}}{→}$Na2CO3 |
10.下列说法错误的是( )
| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 近期出现在北方的雾霾是一种分散系,带活性碳口罩的原理是吸附作用 | |
| C. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 我国部分城市在推广使用的“甲醇汽油”有降低排放废气的优点,无任何负面作用 |
20.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )
| A. | [Co(NH3)4 Cl2]Cl | B. | [Co(NH3)6]Cl3 | C. | [Cu(NH3)4]Cl2 | D. | [Co(NH3)3 Cl3] |
7.已知:2Fe2++Br2=2Fe3++2Br-,2Br-+Cl2=Br2+2Cl-.现向含有amolFeBr2的溶液中,通入xmolCl2.下列各项为通入Cl2过程中,溶液中所发生反应的离子方程式,其中不正确的是( )
| A. | x=0.4a,2Fe2++Cl2=2Fe3++2Cl- | |
| B. | x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- | |
| C. | x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- | |
| D. | x=0.6a,2Br-+Cl2=Br2+2Cl- |
4.金属的熔沸点与金属键强弱有关,判断下列金属熔点逐渐升高的是( )
| A. | Li、Na、K | B. | Na、Mg、Al | C. | Li、Be、Mg | D. | Li、Na、Mg |
6.汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体CO2和N2等.
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1.恒温恒容条件下,不能说明该反应已达到平衡状态的是CD(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).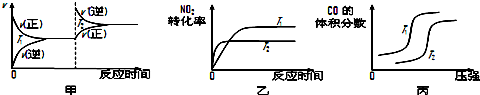
汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=81.
(2)平衡时,甲容器中CO的转化率是90%;平衡时,比较容器中H2O的转化率:乙<甲(填“>”、“<”或“=”,下同);丙=甲.
(3)已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol.贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式是CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol?1.
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1.恒温恒容条件下,不能说明该反应已达到平衡状态的是CD(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).

汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=81.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
(3)已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol.贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式是CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol?1.