题目内容
13.从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘.活性炭吸附法是工业提碘的方法之一,其流程如图: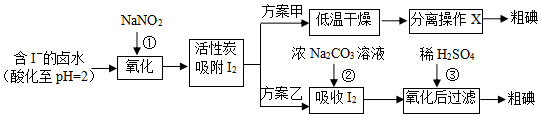
资料显示:Ⅰ.pH=2时,NaNO2溶液只能将 I-氧化为I2,同时生成NO
Ⅱ.I2+5Cl2+6H2O═2HIO3+10HCl
Ⅲ.5SO32-+2IO3-+2H+═I2+5SO42-+H2O
(1)反应①的离子方程式2NO2-+4H++2I-═2NO+I2+2H2O.
(2)方案甲中,根据I2的特性,分离操作X的方法是升华或加热、冷凝结晶.
(3)已知:反应②中每吸收3mol I2转移5mol电子,离子方程式是3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-.
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2.
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-.请分别检验滤液中的I-、IO3-,将实验方案补充完整.
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
a.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在.
b.从水层取少量溶液于试管中,加入几滴淀粉溶液,滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-;另取从水层取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-.
分析 pH=2时,卤亚硝酸钠具有氧化性,碘离子具有还原性,二者发生氧化还原反应①2NO2-+4H++2I-═2NO+I2+2H2O,用活性炭吸附生成的碘单质,通过方案甲低温干燥,升华或加热、冷凝结晶可得粗碘;通过方案乙,用浓碳酸钠溶液吸收碘单质,3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-,再加入稀硫酸,氧化KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,可得粗碘,据此分析可得.
解答 解:(1)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下二者发生氧化还原反应生成一氧化氮和碘和水,离子反应方程式为2NO2-+4H++2I-═2NO+I2+2H2O;
故答案为:2NO2-+4H++2I-═2NO+I2+2H2O;
(2)碘易升华,方案甲中,分离操作X为升华或加热、冷凝结晶;
故答案为:升华或加热、冷凝结晶;
(3)反应②中每吸收3mol I2转移5mol电子,说明生成I-、IO3-,则该离子方程式为:3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-;
故答案为:3I2+3CO32-=5I-+IO3-+3CO2或3I2+6CO32-+3H2O=5I-+IO3-+6HCO3-;
(4)氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2,而亚硝酸钠仅能把碘离子氧化为碘单质,故该工艺中氧化卤水中的I-选择了价格较高的NaNO2;
故答案为:氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2;
(5)检验滤液中的I-、IO3-,利用碘离子被氧化生成碘单质检验,碘酸根离子被还原生成碘单质检验,方法为:从水层取少量溶液于试管中,加入几滴淀粉溶液,滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-,
另取从水层取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-;
故答案为:从水层取少量溶液于试管中,加入几滴淀粉溶液,滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-;另取从水层取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-.
点评 本题考查了碘单质的提取和实验设计,涉及化学方程式的书写,氧化还原反应,资源利用等知识,掌握物质性质及题目信息的利用是关键,题目难度中等.

| A. | 制取CuSO4:Cu$\stackrel{浓H_{2}SO_{4}、△}{→}$CuSO4 | |
| B. | 制取Cu(NO3)2:Cu$\stackrel{O_{2}、△}{→}$ $\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| C. | 制取Al(OH)3:Al$\stackrel{NaOH}{→}$ $\stackrel{H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 制取Na2CO3:Na$\stackrel{O_{2}}{→}$ $\stackrel{CO_{2}}{→}$Na2CO3 |
| A. | Li、Na、K | B. | Na、Mg、Al | C. | Li、Be、Mg | D. | Li、Na、Mg |
| A. | ①②③④ | B. | ③①②④ | C. | ④②③① | D. | ①③②④ |
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1.恒温恒容条件下,不能说明该反应已达到平衡状态的是CD(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是乙(填代号).
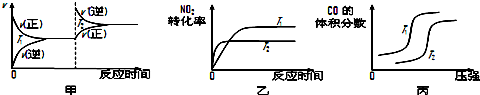
汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=81.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
(3)已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41KJ•mol.贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式是CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ•mol?1.
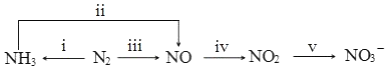
 .
.