题目内容
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图.

请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图象.
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是 ;
(3)图中5号元素在周期表中的位置是 ;
(4)图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是: .
(5)同周期内,随原子序数增大,I1值增大.但个别元素的I1值出现反常现试预测下列关系式中正确的是 .
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键 .

请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na--Ar之间六种元素用短线连接起来,构成完整的图象.
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是
(3)图中5号元素在周期表中的位置是
(4)图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是:
(5)同周期内,随原子序数增大,I1值增大.但个别元素的I1值出现反常现试预测下列关系式中正确的是
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(6)用氢键表示式写出HF溶液中存在的所有氢键
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素;
(2)同一主族元素的第一电离能随着原子序数的增大而减小;
(3)图中6号元素为Cl;
(4)含有氢键的氢化物沸点较高;
(5)同一周期从左到右,I1值增大,但是第ⅤA族元素的I1值大于第ⅥA族的小于第ⅥⅠA的;
(6)能形成氢键的原子为N、O、F和氢原子之间,氢键是分子之间的相互作用力.
(2)同一主族元素的第一电离能随着原子序数的增大而减小;
(3)图中6号元素为Cl;
(4)含有氢键的氢化物沸点较高;
(5)同一周期从左到右,I1值增大,但是第ⅤA族元素的I1值大于第ⅥA族的小于第ⅥⅠA的;
(6)能形成氢键的原子为N、O、F和氢原子之间,氢键是分子之间的相互作用力.
解答:
解:(1)根据图片知,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第ⅡA元素第一电离能大于第ⅢA元素,第ⅤA族的第一电离能大于第ⅥA族元素,所以其图象为 ;
;
故答案为: ;
;
(2)根据图片知,同一主族元素的第一电离能随着原子序数的增大而减小,
故答案为:同一主族元素的第一电离能随着原子序数的增大而减小;
(3)图中6号元素为Cl,处于第三周期、第ⅥA族,故答案为:第三周期 第ⅥA族;
(4)P、S、Cl三种元素的氢化物中只存在分子间作用力,不含氢键,N、O、F三种元素的氢化物中含有氢键,氢键的存在导致其氢化物沸点升高,
故答案为:因同主族上一周期的元素的氢化物分子间存在氢键;
(5)同一周期中,同周期内,随原子序数增大,I1值增大,但是第ⅤA族元素的I1值大于第ⅥA族的小于第VIIA的,则E(砷)>E(硒),E(溴)>E;
故答案为:①③;
(6)N、O、F和氢原子之间能形成氢键,F的氢化物溶液剂为氢氟酸的水溶液,含有HF分子以及H2O分子,存在的所有氢键为F-H…F、F-H…O、O-F…F、O-H…O,
故答案为:F-H…F、F-H…O、O-F…F、O-H…O.
 ;
;故答案为:
 ;
;(2)根据图片知,同一主族元素的第一电离能随着原子序数的增大而减小,
故答案为:同一主族元素的第一电离能随着原子序数的增大而减小;
(3)图中6号元素为Cl,处于第三周期、第ⅥA族,故答案为:第三周期 第ⅥA族;
(4)P、S、Cl三种元素的氢化物中只存在分子间作用力,不含氢键,N、O、F三种元素的氢化物中含有氢键,氢键的存在导致其氢化物沸点升高,
故答案为:因同主族上一周期的元素的氢化物分子间存在氢键;
(5)同一周期中,同周期内,随原子序数增大,I1值增大,但是第ⅤA族元素的I1值大于第ⅥA族的小于第VIIA的,则E(砷)>E(硒),E(溴)>E;
故答案为:①③;
(6)N、O、F和氢原子之间能形成氢键,F的氢化物溶液剂为氢氟酸的水溶液,含有HF分子以及H2O分子,存在的所有氢键为F-H…F、F-H…O、O-F…F、O-H…O,
故答案为:F-H…F、F-H…O、O-F…F、O-H…O.
点评:本题考查了第一电离能的变化趋势及氢键对物质沸点的影响,题目难度中等,注意“同一周期元素中,元素第一电离能的变化趋势,及异常现象”,为易错点.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列有关电解质溶液中,说法正确的是( )
| A、0.2mol/L CH3COONa溶液和0.1mol/L HCl溶液等体积混合之后:c(Na+)=2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.2mol/L |
| B、0.1mol/LNa2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D、25℃时,向10mL pH=4的盐酸中,加入pH=10的一元碱BOH溶液至pH刚好等于7,则反应后的溶液总体积:V总≤20mL |
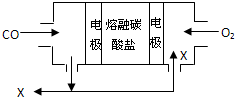 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
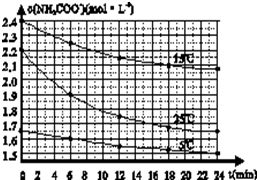 某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )| A、0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B、c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C、25℃时0~6 min,v(NH2COO-)为0.05 mol?L-1?min-1 |
| D、15℃时,第30 min时,c(NH2COO-)为2.0 mol?L-1 |
a1和a2分别为A在两个恒容容器中平衡体系A(g)?2B(g) 和2A(g)?B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是( )
| A、a1、a2均减小 |
| B、a1、a2均增大 |
| C、a1增大,a2减小 |
| D、a1减小,a2增大 |
NaCl是一种化工原料,可以制备一系列物质(如图).下列说法正确的是( )


| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳与Cl2的反应中,Cl2是氧化剂,Ca(OH)2是还原剂 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应中有4个反应属于氧化还原反应 |
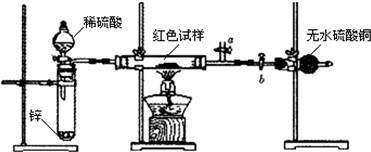 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.