题目内容
NaCl是一种化工原料,可以制备一系列物质(如图).下列说法正确的是( )


| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳与Cl2的反应中,Cl2是氧化剂,Ca(OH)2是还原剂 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应中有4个反应属于氧化还原反应 |
考点:氧化还原反应,氯气的化学性质
专题:氧化还原反应专题,卤族元素
分析:A.NaHCO3在水中的溶解度比Na2CO3的小;
B.发生2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,只有Cl元素化合价发生变化;
C.铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D.根据元素的化合价是否变化判断.
B.发生2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,只有Cl元素化合价发生变化;
C.铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D.根据元素的化合价是否变化判断.
解答:
解:A.在饱和碳酸钠溶液中通入二氧化碳气体,溶液变浑浊,生成碳酸氢钠,可说明NaHCO3在水中的溶解度比Na2CO3的小,故A错误;
B.2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,Cl元素的化合价既升高又降低,所以Cl2既是氧化剂,又是还原剂,故B错误;
C.氯气为活泼非金属性单质,具有较强的氧化性,铁能在氯气中燃烧生成棕黄色的烟FeCl3,故C错误;
D.题中的电解以及氯气与氢气、氢氧化钙的反应都是氧化还原反应,共4个,故D正确.
故选D.
B.2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,Cl元素的化合价既升高又降低,所以Cl2既是氧化剂,又是还原剂,故B错误;
C.氯气为活泼非金属性单质,具有较强的氧化性,铁能在氯气中燃烧生成棕黄色的烟FeCl3,故C错误;
D.题中的电解以及氯气与氢气、氢氧化钙的反应都是氧化还原反应,共4个,故D正确.
故选D.
点评:本题考查了盐的溶解性、氧化还原反应、氧化剂还原剂等问题,是小型综合题,注意氧化还原反应、氧化剂还原剂根据化合价的变化判断即可.

练习册系列答案
相关题目
分子式为C5H12O的醇与C5H10O2的酸发生酯化反应最多可形成多少种酯( )
| A、8种 | B、16种 |
| C、24种 | D、32种 |
正在火星上工作的美国“勇气”号、“机遇”号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O.以下叙述正确的是( )
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
以下对实验操作的说法正确的是( )
| A、由于合金中金属的活泼性不同所以合金都易生锈 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、配制FeCl3溶液时,应将FeCl3溶解在适量的HCl中 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
a、b、c、d是四种短周期的主族元素.其中d的质子数最大,a、b、d同周期;a、c同主族. a的原子结构示意图为: ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: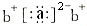 .下列叙述正确的是( )
.下列叙述正确的是( )
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: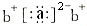 .下列叙述正确的是( )
.下列叙述正确的是( )| A、原子半径:a>c>d |
| B、非金属性:c>a>d |
| C、相应氢化物的沸点:d>c>a |
| D、c与a、c与b均能形成两种化合物 |
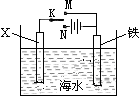 已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )
已知海水中含有的离子主要有Na+、Mg2+、Cl-、Br-,利用如图装置进行实验探究,下列说法正确的是( )| A、X为锌棒,K置于M,可减缓铁的腐蚀,铁电极上发生的反应为2H++2e-=H2↑ |
| B、X为锌棒,K置于M,外电路电流方向是从X到铁 |
| C、X为碳棒,K置于N,可减缓铁的腐蚀,利用的是外加电流的阴极保护法 |
| D、X为碳棒,K置于N,在X电极周围首先失电子的是Cl- |
等质量的O2和CO2相比较,下列叙述正确的是( )
| A、体积比为11:8 |
| B、分子个数之比为1:1 |
| C、物质的量之比为11:8 |
| D、原子个数之比为12:11 |
