题目内容
 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.②CuO高温灼烧时生成Cu2O和O2.
为探究某红色铜样品中是否含有Cu2O,甲、乙两同学分别设计了如下方案:
Ⅰ甲同学方案:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,最后称得坩埚和试样的总质量为c g.
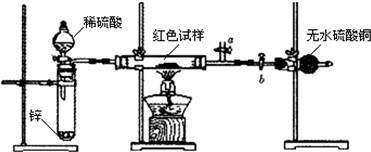
Ⅱ乙同学方案:按下图装置进行实验.
(1)甲同学方案中,坩埚内发生反应的化学方程式为:
(2)为使乙同学方案更科学、合理、安全,可采取的正确措施和操作有:
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
C.先加热红色试样一段时间,在通入氢气
D.先关闭活塞b,打开活塞a,通-段时间氢气,然后后关闭活塞a,打开活塞b,再加热试样
(3)丙同学认为甲乙两位同学的方法都不够简单,用试管和常用稀酸即可检验试样中是否含有Cu2O,丙同学使用的稀酸是
考点:铜金属及其重要化合物的主要性质,性质实验方案的设计
专题:
分析:(1)根据Cu在空气中加热被氧化成氧化铜,再根据CuO高温灼烧时生成Cu2O和O2书写;根据铜元素守恒计算得出正确结论;
(2)根据水的存在会对实验结果造成影响来回答判断.
(3)在验证是否有Cu2O时,可用利用Cu2O+H2SO4=CuSO4+Cu+H2O,若在红色固体中加入硫酸或者盐酸但不能用硝酸,因为硝酸具有强氧化性,即使没有Cu2O也会把Cu氧化成铜离子,最终看现象出现蓝色溶液说明有氧化亚铜,否则没有.
(2)根据水的存在会对实验结果造成影响来回答判断.
(3)在验证是否有Cu2O时,可用利用Cu2O+H2SO4=CuSO4+Cu+H2O,若在红色固体中加入硫酸或者盐酸但不能用硝酸,因为硝酸具有强氧化性,即使没有Cu2O也会把Cu氧化成铜离子,最终看现象出现蓝色溶液说明有氧化亚铜,否则没有.
解答:
解:(1)根据Cu在空气中加热被氧化成氧化铜,再根据CuO高温灼烧时生成Cu2O和O2,则坩埚内发生反应的化学方程式为
2Cu+O2
2CuO 4CuO
2Cu2O+O2↑
根据铜元素守恒,则2Cu~Cu2O
128 144
b-a c-a
=
,解得c=
,故若红色粉末中含有Cu2O,则a、b与c的应符合的数学关系式为c<
,
在空气中高温灼烧至质量恒定,这一步骤至少需称量2次,加上前面的2次称量,故该实验方案最少得进行4次称量,
故答案为:2Cu+O2
2CuO 4CuO
2Cu2O+O2↑;c<
,4;
(2)根据硫酸铜是否变蓝判断是否含有氧化亚铜时,要注意水的干扰因素,所以制取的氢气要干燥,可以在氢气发生器与硬质玻璃管之间加一个干燥装置,所以A正确,并且要将空气中的水的干扰排除,可以在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管,所以B正确,实验前要将装置中的空气排净,应先通入氢气排空气,所以C错误,D正确,故答案为:ABD;
(3)根据以上分析可以选用稀H2SO4或稀HCl;对应现象和结论是向试管中滴加稀硫酸,充分振荡.若发现溶液变为蓝色,则说明样品中混有Cu2O,若没有发现溶液变为蓝色,则说明样品中没有Cu2O;离子方程式为Cu2O+2H+=Cu+Cu2++H2O;
故答案:稀H2SO4或稀HCl;向试管中滴加稀硫酸,充分振荡.若发现溶液变为蓝色,则说明样品中混有Cu2O,若没有发现溶液变为蓝色,则说明样品中没有Cu2O;Cu2O+2H+=Cu+Cu2++H2O.
2Cu+O2
| ||
| ||
根据铜元素守恒,则2Cu~Cu2O
128 144
b-a c-a
| 128 |
| 144 |
| b-a |
| c-a |
| 9b-a |
| 8 |
| 9b-a |
| 8 |
在空气中高温灼烧至质量恒定,这一步骤至少需称量2次,加上前面的2次称量,故该实验方案最少得进行4次称量,
故答案为:2Cu+O2
| ||
| ||
| 9b-a |
| 8 |
(2)根据硫酸铜是否变蓝判断是否含有氧化亚铜时,要注意水的干扰因素,所以制取的氢气要干燥,可以在氢气发生器与硬质玻璃管之间加一个干燥装置,所以A正确,并且要将空气中的水的干扰排除,可以在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管,所以B正确,实验前要将装置中的空气排净,应先通入氢气排空气,所以C错误,D正确,故答案为:ABD;
(3)根据以上分析可以选用稀H2SO4或稀HCl;对应现象和结论是向试管中滴加稀硫酸,充分振荡.若发现溶液变为蓝色,则说明样品中混有Cu2O,若没有发现溶液变为蓝色,则说明样品中没有Cu2O;离子方程式为Cu2O+2H+=Cu+Cu2++H2O;
故答案:稀H2SO4或稀HCl;向试管中滴加稀硫酸,充分振荡.若发现溶液变为蓝色,则说明样品中混有Cu2O,若没有发现溶液变为蓝色,则说明样品中没有Cu2O;Cu2O+2H+=Cu+Cu2++H2O.
点评:本题是一道探究物质组成和实验方案设计的综合性试题,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
已知某元素的前8个电离能(I1/kJ?mol-1):I1=577,I2=1820,I3=2740,I4=11600,I5=14800,I6=18400,I7=23400,I8=27500.该元素原子的最外层有几个电子?( )
| A、1个 | B、2个 | C、3个 | D、4个 |
下列实验方案可行的是( )
| A、在淀粉溶液中加稀硫酸充分反应后,再加入银氨溶液,可检验淀粉的水解产物 |
| B、用溴水可以鉴别苯、乙醇、四氯化碳三种液体 |
| C、除去苯中的苯酚,可加入NaOH溶液后再分液 |
| D、将氯乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明氯乙烷发生了消去反应. |
下列能大量共存且溶液为无色透明的离子组是( )
| A、Al3+、Na+、HCO3-、Cl- |
| B、Fe3+、NO3-、Cl-、SO42- |
| C、Na+、H+、SO32-、NO3- |
| D、SiO32-、Na+、K+、CO32- |
分子式为C5H12O的醇与C5H10O2的酸发生酯化反应最多可形成多少种酯( )
| A、8种 | B、16种 |
| C、24种 | D、32种 |

 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
