题目内容
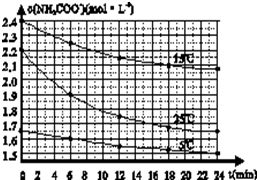 某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )| A、0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B、c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C、25℃时0~6 min,v(NH2COO-)为0.05 mol?L-1?min-1 |
| D、15℃时,第30 min时,c(NH2COO-)为2.0 mol?L-1 |
考点:盐类水解的原理
专题:盐类的水解专题
分析:A、0-12min5°C反应速率=
=0.0083mol/L?min,25°C时反应速率=
0.0375mol/L?min,15°C反应速率=
=0.0208mol/L?min;
B、c(NH2COO-)将随反应时间的不断延长最后达到平衡状态,浓度不再变化;
C、25℃时,0~6min,v(NH2COO-)=
=0.05mol?L-1?min-1;
D、15℃时,第30min时,可以依据每6分钟的浓度减小分析推断,0-6min,浓度减小=2.4mol/L-2.25mol/L=0.15mol/L,6-12min浓度减小=2.25mol/L-2.15mol/L=0.1mol/L,12-18min浓度减小=2.15mol/L-2.1mol/L=0.05mol/L,18-24min,浓度减小=2.1mol/L-2.075mol/L=0.025mol/L,浓度减少的浓度为上一6min浓度的一半,推断30min,c(NH2COO-)减少0.0125mol/L,即c(NH2COO-)=2.075mol/L-0.0125mol/L=2.0625mol/L>2.0mol?L-1.
| 1.65mol/L-1.55mol/L |
| 12min |
| 2.2mol/L-1.75mol/L |
| 12min |
| 2.4mo/L-2.15mol/L |
| 12min |
B、c(NH2COO-)将随反应时间的不断延长最后达到平衡状态,浓度不再变化;
C、25℃时,0~6min,v(NH2COO-)=
| 2.2mol/L-1.9mol/L |
| 6min |
D、15℃时,第30min时,可以依据每6分钟的浓度减小分析推断,0-6min,浓度减小=2.4mol/L-2.25mol/L=0.15mol/L,6-12min浓度减小=2.25mol/L-2.15mol/L=0.1mol/L,12-18min浓度减小=2.15mol/L-2.1mol/L=0.05mol/L,18-24min,浓度减小=2.1mol/L-2.075mol/L=0.025mol/L,浓度减少的浓度为上一6min浓度的一半,推断30min,c(NH2COO-)减少0.0125mol/L,即c(NH2COO-)=2.075mol/L-0.0125mol/L=2.0625mol/L>2.0mol?L-1.
解答:
解:A、0-12min5°C反应速率=
=0.0083mol/L?min,25°C时反应速率=
0.0375mol/L?min,15°C反应速率=
=0.0208mol/L?min,比较可知0~12min,初始浓度越大的实验,水解反应速率越小,故A错误;
B、c(NH2COO-)将随反应时间的不断延长最后达到平衡状态,浓度不再变化,故B错误;
C、25℃时,0~6min,v(NH2COO-)=
=0.05mol?L-1?min-1,故C正确;
D、15℃时,第30min时,可以依据每6分钟的浓度减小分析推断,0-6min,浓度减小=2.4mol/L-2.25mol/L=0.15mol/L,6-12min浓度减小=2.25mol/L-2.15mol/L=0.1mol/L,12-18min浓度减小=2.15mol/L-2.1mol/L=0.05mol/L,18-24min,浓度减小=2.1mol/L-2.075mol/L=0.025mol/L,浓度减少的浓度为上一6min浓度的一半,推断30min,c(NH2COO-)减少0.0125mol/L,即c(NH2COO-)=2.075mol/L-0.0125mol/L=2.0625mol/L>2.0mol?L-1,故D错误;
故选C.
| 1.65mol/L-1.55mol/L |
| 12min |
| 2.2mol/L-1.75mol/L |
| 12min |
| 2.4mo/L-2.15mol/L |
| 12min |
B、c(NH2COO-)将随反应时间的不断延长最后达到平衡状态,浓度不再变化,故B错误;
C、25℃时,0~6min,v(NH2COO-)=
| 2.2mol/L-1.9mol/L |
| 6min |
D、15℃时,第30min时,可以依据每6分钟的浓度减小分析推断,0-6min,浓度减小=2.4mol/L-2.25mol/L=0.15mol/L,6-12min浓度减小=2.25mol/L-2.15mol/L=0.1mol/L,12-18min浓度减小=2.15mol/L-2.1mol/L=0.05mol/L,18-24min,浓度减小=2.1mol/L-2.075mol/L=0.025mol/L,浓度减少的浓度为上一6min浓度的一半,推断30min,c(NH2COO-)减少0.0125mol/L,即c(NH2COO-)=2.075mol/L-0.0125mol/L=2.0625mol/L>2.0mol?L-1,故D错误;
故选C.
点评:本题考查了图象分析判断,反应速率概念的计算应用,浓度变化规律的分析判断是解题关键,题目难度较大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
下列各物质中,所有原子都满足最外层8电子结构的是( )
| A、BeCl2 |
| B、PCl3 |
| C、NH3 |
| D、PCl5 |
下列能大量共存且溶液为无色透明的离子组是( )
| A、Al3+、Na+、HCO3-、Cl- |
| B、Fe3+、NO3-、Cl-、SO42- |
| C、Na+、H+、SO32-、NO3- |
| D、SiO32-、Na+、K+、CO32- |
将1.5克某物质在氧气中完全燃烧,产物为4.4g二氧化碳和2.7g水,根据此实验事实,不能得出的实验结果是( )
| A、一定含有碳、氢两种元素 |
| B、一定含有氧元素 |
| C、该物质为有机化合物 |
| D、氢元素的质量分数为20% |
下列叙述正确的是( )
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
下列除去杂质的方法正确的是( )
| A、除去 CO2 中混有的 CO:用澄清石灰水洗气 |
| B、除去 BaCO3 固体中混有的 BaSO4:加过量盐酸后,过滤、洗涤 |
| C、除去 FeCl2 溶液中混有的 FeCl3:加入过量铁粉,过滤 |
| D、除去 Cu 粉中混有的 CuO:加适量稀硝酸后,过滤、洗涤 |
以下对实验操作的说法正确的是( )
| A、由于合金中金属的活泼性不同所以合金都易生锈 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、配制FeCl3溶液时,应将FeCl3溶解在适量的HCl中 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |