题目内容
某温度下在容积固定的密闭容器中,下列反应达到平衡:M(g)+H2O(g)?N(g)+H2(g)
①该反应的平衡常数为 .该温度下,向容器中充入1molM、3mol H2O、2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
②结合表中数据,判断下列说法中正确的是 .
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O,当达平衡时放出a KJ热量,则该反应的△H= .
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
②结合表中数据,判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的量之比为1:4时,M的转化率为0.85
③该温度下,向容器中充入2molM、2mol H2O,当达平衡时放出a KJ热量,则该反应的△H=
考点:化学平衡的计算,反应速率的定量表示方法
专题:
分析:①根据平衡常数K=
来书写;计算出此温度下的平衡常数K的数值,与浓度商Qc作比较,即得出V正和V逆的大小关系;
②A、通过表中的数据即可得出结论;
B、根据转化率=
来分析;
C、CO和H2O(g)的转化率之比等于计量数之比;
D、结合平衡常数进行计算;
③2molM、2mol H2O,当达平衡时放出a KJ热量,依据平衡常数分析可知,转化率为0.5,反应1molM放出akJ的热量.
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
②A、通过表中的数据即可得出结论;
B、根据转化率=
| △n |
| n |
C、CO和H2O(g)的转化率之比等于计量数之比;
D、结合平衡常数进行计算;
③2molM、2mol H2O,当达平衡时放出a KJ热量,依据平衡常数分析可知,转化率为0.5,反应1molM放出akJ的热量.
解答:
解:①平衡常数K=
; 化学平衡常数k只受温度的影响,在此温度下,当n(CO):n(H2O)=1:1时,平衡时CO(g)、H2O(g)、CO2(g)、H2(g)的浓度相等,即化学平衡常数K=
=1,在该温度下,向容器中充入1molCO、3mol H2O、2mol CO2、1.5molH2时,浓度商Qc=
=1=K,即为平衡状态,故V正=V逆,
故答案为:1;=;
②A、从表中数据可知增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低,故A正确;
B、物质的转化率=
,而根据反应可知:△n(CO):△n(H2O)=计量数之比=1:1,故若CO与H2O(g)的转化率相同时,二者的初始投入量一定相同,B正确;
C、CO和H2O(g)的转化率之比等于计量数之比,与初始物质的量成反比,故C错误;
D、由计算可知,此温度下反应的平衡常数K=1.设CO与H2O(g)的初始物质的量浓度分别为1mol/L和4mol/L,达平衡时,CO的△C(CO)为Xmol/L,则根据三段式有:CO(g)+H2O(g)?CO2(g)+H2(g)
初始:1mol/L 4mol/L 0mol/L 0mol/L
△C:Xmol/L Xmol/L Xmol/L Xmol/L
平衡:(1-X)mol/L (4-X)mol/L Xmol/L Xmol/L
根据平衡常数K=
=
=1,解得:X=0.8mo/L,故 CO的转化率=
×100%=80%,故D错误.
故选AB;
③2molM、2mol H2O,当达平衡时放出a KJ热量,和1molM、1mol H2O起始量达到相同的平衡状态,平衡常数为1,即转化率为0.5,反应1molM放出akJ的热量,即该反应的△H=-akJ/mol,故答案为:-aKJ/mol.
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
故答案为:1;=;
②A、从表中数据可知增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低,故A正确;
B、物质的转化率=
| △n |
| n |
C、CO和H2O(g)的转化率之比等于计量数之比,与初始物质的量成反比,故C错误;
D、由计算可知,此温度下反应的平衡常数K=1.设CO与H2O(g)的初始物质的量浓度分别为1mol/L和4mol/L,达平衡时,CO的△C(CO)为Xmol/L,则根据三段式有:CO(g)+H2O(g)?CO2(g)+H2(g)
初始:1mol/L 4mol/L 0mol/L 0mol/L
△C:Xmol/L Xmol/L Xmol/L Xmol/L
平衡:(1-X)mol/L (4-X)mol/L Xmol/L Xmol/L
根据平衡常数K=
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| X2 |
| (1-X)(4-X) |
| 0.8mol/L |
| 1mol/L |
故选AB;
③2molM、2mol H2O,当达平衡时放出a KJ热量,和1molM、1mol H2O起始量达到相同的平衡状态,平衡常数为1,即转化率为0.5,反应1molM放出akJ的热量,即该反应的△H=-akJ/mol,故答案为:-aKJ/mol.
点评:本题考查氧化还原反应的计算及化学平衡的计算,为高频考点,侧重学生分析能力和计算能力的考查,注意电子守恒及化学平衡常数K的计算与应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知某元素的前8个电离能(I1/kJ?mol-1):I1=577,I2=1820,I3=2740,I4=11600,I5=14800,I6=18400,I7=23400,I8=27500.该元素原子的最外层有几个电子?( )
| A、1个 | B、2个 | C、3个 | D、4个 |
下列除去杂质的方法正确的是( )
| A、除去 CO2 中混有的 CO:用澄清石灰水洗气 |
| B、除去 BaCO3 固体中混有的 BaSO4:加过量盐酸后,过滤、洗涤 |
| C、除去 FeCl2 溶液中混有的 FeCl3:加入过量铁粉,过滤 |
| D、除去 Cu 粉中混有的 CuO:加适量稀硝酸后,过滤、洗涤 |
下列有关生产、生活中的叙述正确的是( )
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C、明矾可用于水的消毒、杀菌:碳酸钡可用于钡餐透视 |
| D、单晶硅太阳能电池板可以将太阳能直接转变为电能 |
分子式为C5H12O的醇与C5H10O2的酸发生酯化反应最多可形成多少种酯( )
| A、8种 | B、16种 |
| C、24种 | D、32种 |
a、b、c、d是四种短周期的主族元素.其中d的质子数最大,a、b、d同周期;a、c同主族. a的原子结构示意图为: ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: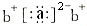 .下列叙述正确的是( )
.下列叙述正确的是( )
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: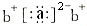 .下列叙述正确的是( )
.下列叙述正确的是( )| A、原子半径:a>c>d |
| B、非金属性:c>a>d |
| C、相应氢化物的沸点:d>c>a |
| D、c与a、c与b均能形成两种化合物 |