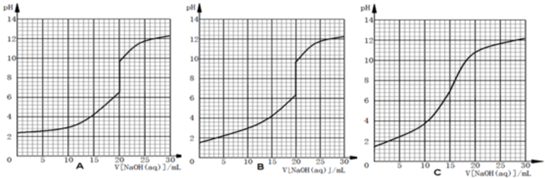
题目内容
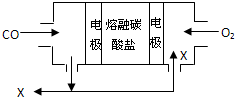 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
考点:电解原理
专题:
分析:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和X的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-.
解答:
解:A.由负极电极反应可知电池工作时参加循环的物质为CO2,故A正确;
B.该燃料电池中通入O2的一极是正极,故B正确;
C、该燃料电池中通入CO的一极是负极,电极反应式为2CO-4e-+2CO32-═4CO2,故C正确;
D、通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,转移0.5mol电子,理论上消耗O22.8L,未指明标准状态,故D错误;
故选:D.
B.该燃料电池中通入O2的一极是正极,故B正确;
C、该燃料电池中通入CO的一极是负极,电极反应式为2CO-4e-+2CO32-═4CO2,故C正确;
D、通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,转移0.5mol电子,理论上消耗O22.8L,未指明标准状态,故D错误;
故选:D.
点评:本题考查原电池原理,根据燃料电池的工作原理规律来分析解答即可,注意电极反应式的正确书写,为易错点.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
下列有关生产、生活中的叙述正确的是( )
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品 |
| C、明矾可用于水的消毒、杀菌:碳酸钡可用于钡餐透视 |
| D、单晶硅太阳能电池板可以将太阳能直接转变为电能 |
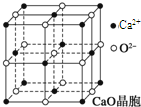
正在火星上工作的美国“勇气”号、“机遇”号探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O.以下叙述正确的是( )
| A、铝热剂就是单指Fe2O3粉和铝粉的混合物 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为2:3:2 |
| D、明矾属硫酸盐,是纯净物 |
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C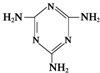 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸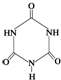 后,三聚氰酸与三聚氰胺分子相互之间通过
后,三聚氰酸与三聚氰胺分子相互之间通过 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题: