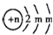题目内容
下列离子方程式中,表达正确的是( )
| A、等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-=BaCO3↓+H2O | ||||
| B、向AlCl3溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
C、用铜作电极电解硫酸溶液:2H2O
| ||||
| D、硫酸亚铁溶液和稀硫酸、过氧化氢混合:Fe2++2H2O2+4H+=Fe3++4H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.等物质的量的NaHCO3溶液和Ba(OH)2溶液,二者反应生成碳酸钡、NaOH和水;
B.氢氧化铝能溶于强碱但不溶于弱碱,所以二者反应生成氢氧化铝沉淀;
C.用铜作电极电解硫酸溶液时,阳极上铜失电子发生氧化反应,阴极上氢离子放电生成氢气;
D.二者反应生成硫酸铁、水.
B.氢氧化铝能溶于强碱但不溶于弱碱,所以二者反应生成氢氧化铝沉淀;
C.用铜作电极电解硫酸溶液时,阳极上铜失电子发生氧化反应,阴极上氢离子放电生成氢气;
D.二者反应生成硫酸铁、水.
解答:
解:A.等物质的量的NaHCO3溶液和Ba(OH)2溶液,二者反应生成碳酸钡、NaOH和水,离子方程式为HCO3-+Ba2++OH-=BaCO3↓+H2O,故A正确;
B.氢氧化铝能溶于强碱但不溶于弱碱,所以二者反应生成氢氧化铝沉淀,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故B错误;
C.用铜作电极电解硫酸溶液时,开始时阳极上铜失电子发生氧化反应,阴极上氢离子放电生成氢气,电池反应式为Cu+2H2O
Cu(OH)2+H2↑,故C错误;
D.二者反应生成硫酸铁、水,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故D错误;
故选A.
B.氢氧化铝能溶于强碱但不溶于弱碱,所以二者反应生成氢氧化铝沉淀,离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故B错误;
C.用铜作电极电解硫酸溶液时,开始时阳极上铜失电子发生氧化反应,阴极上氢离子放电生成氢气,电池反应式为Cu+2H2O
| ||
D.二者反应生成硫酸铁、水,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故D错误;
故选A.
点评:本题考查离子方程式正误判断,为高考高频点,明确物质的性质及离子方程式书写规则即可解答,知道弱电解质、气体、沉淀、络合物都写化学式,易错选项是C,注意活泼金属作阳极,阳极上金属失电子发生氧化反应.

练习册系列答案
相关题目
下列化学方程式改写成离子方程式不正确的是( )
| A、CuCl2+2NaOH═Cu(OH)2↓+2NaCl;Cu2++20H═Cu(OH)2↓ |
| B、BaSO4+2HCl═BaCl2+CO2↑+H2O;SO42-+2H+═CO2↑+H2O |
| C、Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 Ca2++CO32-═CaCO3↓ |
| D、2KOH+H2SO4═K2SO4+2H2O;H++OH-═H2O |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、常温常压下,8gO2和O3的混合物含有2AA个电子 |
| B、29gC4H10中含有的共价键个数为13NA |
| C、1L1 moI?L-1的NaClO溶液中含有ClO的数日为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
染料敏化太阳能电池(简称DSC)工作时类似叶绿素的染料吸收太阳光,产生电子,电子再被电极收集,然后通过外电路,回到反电极产生光电流.该过程中的能量转化形式为( )
| A、太阳能→电能 |
| B、太阳能→化学能 |
| C、化学能→电能 |
| D、电能→化学能 |
为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
| A、铜粉 |
| B、铁粉 |
| C、锌粉 |
| D、Fe3(SO4)3 |
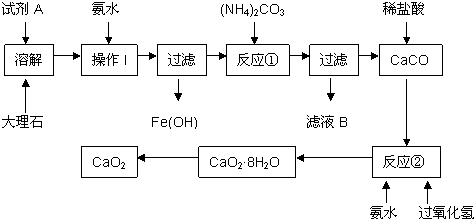
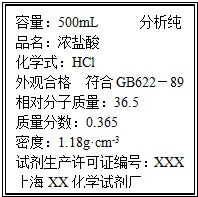 取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.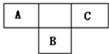 于B原子的质子数,B2-的结构示意图为:
于B原子的质子数,B2-的结构示意图为: