题目内容
可逆反应N2(g)+3H2(g )?2NH3(g),在500℃时,将2mol N2和2mol H2充入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
| A、0.08mol?L-1 |
| B、0.12 mol?L-1 |
| C、0.05 mol?L-1 |
| D、0.14mol?L-1 |
考点:化学反应的可逆性
专题:化学平衡专题
分析:依据反应是可逆反应,不能进行彻底分析计算判断,可以利用极值法分析;
解答:
解:N2(g)+3H2(g)
2NH3(g),依据极值法计算分析,若氮气和氢气全部反应则:2molN2和2mol氢气反应,根据化学方程式计算可知,氮气过量,氢气全部反应生成氨气物质的量为
mol,浓度=
=0.13mol/L,因为反应是可逆反应,不可能进行彻底,所以反应过程中生成的氨气浓度小于0.13mol/L;选项中A、B、C有可能生成,D 不能达到;
故选D.
| ||
| 高温高压 |
| 4 |
| 3 |
| ||
| 10L |
故选D.
点评:本题考查了可逆反应的特征应用,建立化学平衡,反应不能进行彻底,极值假设假设是解题的常用方法,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关蛋白质的叙述中,不正确的是( )
| A、蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解 |
| B、人工合成的具有生命活性的蛋白质-结晶牛胰岛素是1965年我国科学家最先合成的 |
| C、重金属盐能使蛋白质变性,所以误食重金属盐会中毒 |
| D、浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应 |
下列化学方程式改写成离子方程式不正确的是( )
| A、CuCl2+2NaOH═Cu(OH)2↓+2NaCl;Cu2++20H═Cu(OH)2↓ |
| B、BaSO4+2HCl═BaCl2+CO2↑+H2O;SO42-+2H+═CO2↑+H2O |
| C、Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 Ca2++CO32-═CaCO3↓ |
| D、2KOH+H2SO4═K2SO4+2H2O;H++OH-═H2O |
已知链式炔碳C300经过适当处理可得含多个 (不含
(不含 )的链状化合物C300H298,则该分子中含
)的链状化合物C300H298,则该分子中含 的个数为( )
的个数为( )
 (不含
(不含 )的链状化合物C300H298,则该分子中含
)的链状化合物C300H298,则该分子中含 的个数为( )
的个数为( )| A、70 | B、72 | C、74 | D、76 |
下列各组中的反应,属于同一反应类型的是( )
| A、苯的硝化反应;乙烯使溴水褪色 |
| B、葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯 |
| C、乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷 |
| D、乙醇和氧气制乙醛;苯和氢气制环己烷 |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、常温常压下,8gO2和O3的混合物含有2AA个电子 |
| B、29gC4H10中含有的共价键个数为13NA |
| C、1L1 moI?L-1的NaClO溶液中含有ClO的数日为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.2NA |
染料敏化太阳能电池(简称DSC)工作时类似叶绿素的染料吸收太阳光,产生电子,电子再被电极收集,然后通过外电路,回到反电极产生光电流.该过程中的能量转化形式为( )
| A、太阳能→电能 |
| B、太阳能→化学能 |
| C、化学能→电能 |
| D、电能→化学能 |
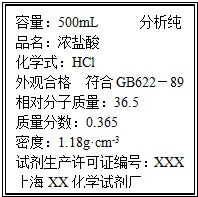 取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.