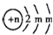题目内容
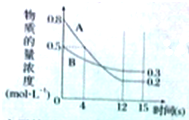 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.(1)从反应开始到12s时,用A表示的 反应速率为
(2)经测定前4s内v(C)=0.05mol?L-1?s-1,则该反应的化学方程式为
(3)请在图中将生成物C的物质的量浓度随时间的变化曲线绘制出来;
(4)若上述反应分别在甲、乙、丙 三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为:
甲:v(A)=0.3mol?L-1?s-1;
乙:v(B)=0.12mol?L-1?s-1;
丙:v(C)=9.6mol?L-1?min-1;
则甲、乙、丙三个容器中反应速率由快到慢的顺序为
考点:反应速率的定量表示方法,化学平衡的影响因素
专题:化学反应速率专题
分析:依据图象可知:AB为反应物,且A的初始物质的量浓度为0.8mol/L,B的初始浓度为0.5mol/L,反应进行到12s时达到平衡,此时A的平衡浓度为0.2mol/L,B的平衡浓度为0.3mol/L,据此可以计算出12s内用A表示的化学反应速率,可以计算出a与b的比值,利用题给4s内v(C)=0.05mol?L-1?s-1,计算出abc的最简整数比,然后绘制图象,比较化学反应速率的快慢即可.
解答:
解:(1)从反应开始到12s时,A的浓度变化量△c=0.8mol/L-0.2mol/L=0.6mol/L,时间为12s,故v(A)=
=
=0.05mol/(L?s),故答案为:0.05mol/(L?s);
(2)12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,经测定前4s内v(C)=0.05mol?L-1?s-1,此时A浓度变化为:0.8mol/L-0.5mol/L=0.3mol/L,此时v(A)=
=0.075mol/(L?s),即v(A):v(C)=0.075:0.05=3:2,故a:b:c=3:1:2,故化学反应方程式为:3A(g)+B(g)?2C(g),故答案为:3A(g)+B(g)?2C(g);
(3)平衡是A变化量为0.6,故C变化量为0.4,可绘制图象如下: ,故答案为:
,故答案为: ;
;
(4)确定A的速率为:甲:v(A)=0.3mol?L-1?s-1;
乙:v(B)=0.12mol?L-1?s-1,故v(A)=3×0.12mol?L-1?s-1=0.36mol?L-1?s-1;
丙:v(C)=9.6mol?L-1?min-1=
=0.16mol?L-1?s-1,故v(A)=
×0.16mol?L-1?min-1=0.24mol?L-1?s-1,故最快的是乙,最慢的是丙,故答案为:乙>甲>丙.
| △c |
| △t |
| 0.6mol/L |
| 12s |
(2)12s时,B的浓度变化量△c=0.5mol/L-0.3mol/L=0.2mol/L,故a:b=0.6:0.2=3:1,经测定前4s内v(C)=0.05mol?L-1?s-1,此时A浓度变化为:0.8mol/L-0.5mol/L=0.3mol/L,此时v(A)=
| 0.3mol/L |
| 4s |
(3)平衡是A变化量为0.6,故C变化量为0.4,可绘制图象如下:
 ,故答案为:
,故答案为: ;
;(4)确定A的速率为:甲:v(A)=0.3mol?L-1?s-1;
乙:v(B)=0.12mol?L-1?s-1,故v(A)=3×0.12mol?L-1?s-1=0.36mol?L-1?s-1;
丙:v(C)=9.6mol?L-1?min-1=
| 9.6mol/L |
| 60s |
| 3 |
| 2 |
点评:本题主要考查化学平衡的变化图象,题目难度不大,可以根据所学知识进行回答,本题要注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
染料敏化太阳能电池(简称DSC)工作时类似叶绿素的染料吸收太阳光,产生电子,电子再被电极收集,然后通过外电路,回到反电极产生光电流.该过程中的能量转化形式为( )
| A、太阳能→电能 |
| B、太阳能→化学能 |
| C、化学能→电能 |
| D、电能→化学能 |
将相同质量的两份铁反别投入1mol/L、体积均为200mL的盐酸、硫酸两份溶液中,放出H2的体积比为2:3,则每份金属铁的质量是( )
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |
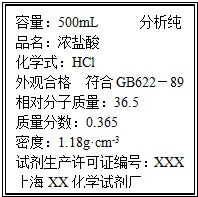 取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体. 于B原子的质子数,B2-的结构示意图为:
于B原子的质子数,B2-的结构示意图为: