题目内容
如表是ⅥA族部分元素的相关性质.
请回答下列问题:
(1)硒的熔点范围可能是 .
(2)碲的化合价可能有 .
(3)硫、硒最高价氧化物对应水化物的酸性强弱顺序是 (填化学式).
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为 .
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式.
Al2Te3+ ═2Al(OH)3↓+ H2Te↑
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)硒的熔点范围可能是
(2)碲的化合价可能有
(3)硫、硒最高价氧化物对应水化物的酸性强弱顺序是
(4)氢硒酸有较强的
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式.
Al2Te3+
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)根据表中数据知,氧族元素单质的熔点随着原子序数增大而增大;
(2)根据表中数据知,氧族元素主要化合价相似;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)元素的非金属性越弱,其氢化物的还原性越强,硒化氢易被氧气氧化生成Se和水;
(5)根据元素守恒知反应物还有水,根据原子守恒配平方程式.
(2)根据表中数据知,氧族元素主要化合价相似;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)元素的非金属性越弱,其氢化物的还原性越强,硒化氢易被氧气氧化生成Se和水;
(5)根据元素守恒知反应物还有水,根据原子守恒配平方程式.
解答:
解:(1)根据表中数据知,氧族元素单质的熔点随着原子序数增大而增大,所以Se的熔点介于S、Te之间,为113℃<Se<450℃,故答案为:113℃<Se<450℃;
(2)根据表中数据知,氧族元素主要化合价相似,根据元素化合价知,Te的化合价可能为-2、+4、+6,
故答案为:-2、+4、+6;
(3)非金属性S>Se,所以其最高价氧化物的水化物酸性H2SO4>H2SeO4 ,故答案为:H2SO4>H2SeO4 ;
(4)Se元素非金属性较弱,则其简单阴离子还原性较强,所以其氢化物具有还原性,硒化氢易被氧气氧化生成Se和水,反应方程式为,故答案为:还原性;2H2Se+O2=2H2O+2Se;
(5)根据元素守恒知反应物还有水,根据原子守恒配平方程式为Al2Te3+6H2O=2Al(OH)3↓+3H2Te,
故答案为:6H2O;3.
(2)根据表中数据知,氧族元素主要化合价相似,根据元素化合价知,Te的化合价可能为-2、+4、+6,
故答案为:-2、+4、+6;
(3)非金属性S>Se,所以其最高价氧化物的水化物酸性H2SO4>H2SeO4 ,故答案为:H2SO4>H2SeO4 ;
(4)Se元素非金属性较弱,则其简单阴离子还原性较强,所以其氢化物具有还原性,硒化氢易被氧气氧化生成Se和水,反应方程式为,故答案为:还原性;2H2Se+O2=2H2O+2Se;
(5)根据元素守恒知反应物还有水,根据原子守恒配平方程式为Al2Te3+6H2O=2Al(OH)3↓+3H2Te,
故答案为:6H2O;3.
点评:本题考查同一主族元素性质递变规律,侧重考查学生分析、归纳总结能力,涉及氧化还原反应、方程式的配平、元素周期律等知识点,以碱金属族、卤族元素为例熟练掌握同一主族元素性质递变规律,题目难度不大.

练习册系列答案
相关题目
下列各组中的反应,属于同一反应类型的是( )
| A、苯的硝化反应;乙烯使溴水褪色 |
| B、葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯 |
| C、乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷 |
| D、乙醇和氧气制乙醛;苯和氢气制环己烷 |
将相同质量的两份铁反别投入1mol/L、体积均为200mL的盐酸、硫酸两份溶液中,放出H2的体积比为2:3,则每份金属铁的质量是( )
| A、2.8g | B、5.6g |
| C、8.4g | D、11.2g |
下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数的2.5倍,B元素的原子核内质子数等于中子数,下列叙述不正确的是( )
| B | ||
| A | C |
| A、A为ⅤA族元素 |
| B、B为第二周期的元素 |
| C、C是周期表中化学性质最活泼的非金属 |
| D、三种元素都为非金属元素 |
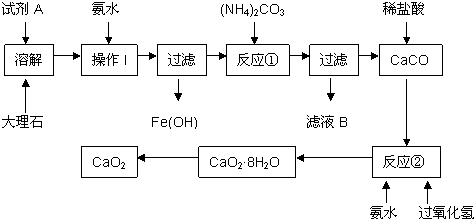
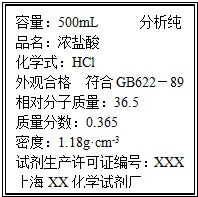 取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为13.7g的Na2CO3和NaHCO3的固体混合物,与100mL 2.00mol?L-1的盐酸恰好完全反应不再放出气体.