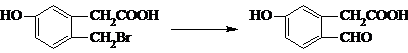
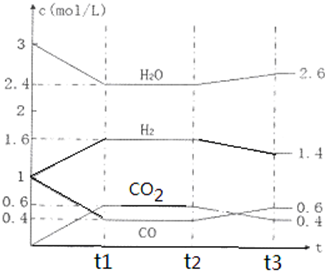
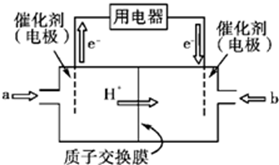
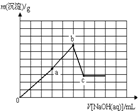
题目内容
将含有2.05g某高价含氧酸的钙盐的溶液A与含1.20g碳酸盐的溶液B混合,恰好完全反应,生成1.25g白色沉淀C.将滤去沉淀C的滤液蒸发,得到白色固体D,继续加热D时,D分解只得两种气态物质的混合物,在0℃、1×105 Pa下,体积变为0.56 L,并得到0.90g液态水,另一种气态物质为气态氧化物R2O.试回答:
(1)白色沉淀C的物质的量为 mol;
(2)A的摩尔质量为 ,B的摩尔质量为 ;
(3)R2O与H2O的物质的量之比为 ,生成D的质量为 ,D的摩尔质量为 ,R2O的相对分子质量为 ,R2O的化学式是 ;
(4)写出A和B混合的化学方程式 .
(1)白色沉淀C的物质的量为
(2)A的摩尔质量为
(3)R2O与H2O的物质的量之比为
(4)写出A和B混合的化学方程式
考点:无机物的推断
专题:
分析:由A+B=C+D可推知,白色沉淀C为CaCO3,白色固体D是一种含三种元素的含氧酸盐,分解只得两种气态物质的混合物,D只能是NH4NO3,分解生成的R2O为N2O.A为Ca(NO3)2,B为(NH4)2CO3.据此可解答.
解答:
解:由A+B=C+D知,C为CaCO3,D是一种含三种元素的含氧酸盐,分解只得两种气态物质的混合物,该盐只能是NH4NO3,分解生成的R2O为N2O.A为Ca(NO3)2,B为(NH4)2CO3.
(1)根据n=
=
=0.0125mol;故答案为:0.0125 mol;
(2)A为Ca(NO3)2,摩尔质量为164 g?mol-,B为(NH4)2CO3,摩尔质量为96 g?mol-1,故答案为:164 g?mol-;96 g?mol-1;
(3)NH4NO3分解生成N2O为H2O,N的价态由-3价和+5价均变化为+1价,根据化合价升降相等,N2O与H2O的计量数之比为1:2,配平化学反应方程式为NH4NO3
N2O+2H2O,故N2O与H2O的物质的量之比为1:2;
D为NH4NO3,其摩尔质量为80g/mol,R2O为N2O,其相对分子质量为44,;
根据质量守恒,D的质量等于A和B的质量减去C的质量,即为2.05g+1.20g-1.25g=2.00g;
故答案为:1:2;2.00g;80g/mol;44;N2O;
(4)Ca(NO3)2和(NH4)2CO3反应生成CaCO3和NH4NO3,其反应属于复分解反应,反应方程式为Ca(NO3)2+(NH4)2CO3=CaCO3+2NH4NO3.
故答案为:Ca(NO3)2+(NH4)2CO3=CaCO3+2NH4NO3.
(1)根据n=
| m |
| M |
| 1.25g |
| 100g/mol |
(2)A为Ca(NO3)2,摩尔质量为164 g?mol-,B为(NH4)2CO3,摩尔质量为96 g?mol-1,故答案为:164 g?mol-;96 g?mol-1;
(3)NH4NO3分解生成N2O为H2O,N的价态由-3价和+5价均变化为+1价,根据化合价升降相等,N2O与H2O的计量数之比为1:2,配平化学反应方程式为NH4NO3
| ||
D为NH4NO3,其摩尔质量为80g/mol,R2O为N2O,其相对分子质量为44,;
根据质量守恒,D的质量等于A和B的质量减去C的质量,即为2.05g+1.20g-1.25g=2.00g;
故答案为:1:2;2.00g;80g/mol;44;N2O;
(4)Ca(NO3)2和(NH4)2CO3反应生成CaCO3和NH4NO3,其反应属于复分解反应,反应方程式为Ca(NO3)2+(NH4)2CO3=CaCO3+2NH4NO3.
故答案为:Ca(NO3)2+(NH4)2CO3=CaCO3+2NH4NO3.
点评:本题考查无机物的推断,题目难度不大,该题的突破口是白色固体D分解只得两种气态物质的混合物,这是解答本题的关键点.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
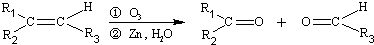 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
 :
:
 属芳香醚,其同系物的通式为:
属芳香醚,其同系物的通式为: