题目内容
在1L含0.001mol/L SO42-的溶液中加入0.01mol BaCl2,此时溶液中SO42-的浓度是多少?[已知Ksp(BaSO4)=1.08×10-10].
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:计算题
分析:根据方程式计算可知氯化钡过量,根据Ksp和溶液中剩余的钡离子的浓度求出溶液中硫酸根离子的浓度.
解答:
解:发生反应的离子方程式为:Ba2++SO42-=BaSO4↓,已知n(SO42-)=0.001mol,n(Ba2+)=0.01mol,则钡离子过量,
剩余的钡离子浓度为c(Ba2+)=
=0.009mol/L,则c(SO42-)=
=
=1.2×10-8mol/L,
答:此时SO42-的浓度是1.2×10-8mol/L.
剩余的钡离子浓度为c(Ba2+)=
| 0.01mol-0.001mol |
| 1L |
| Ksp |
| c(Ba2+) |
| 1.08×10-10 |
| 0.009 |
答:此时SO42-的浓度是1.2×10-8mol/L.
点评:本题主要考查的是溶液中离子浓度的计算、溶度积常数的应用,侧重于考查学生的计算能力,题目难度中等.

练习册系列答案
相关题目
固体AgCl放在较浓的KI溶液中振荡,则部分AgCl转化为AgI,原因是( )
| A、AgI比AgCl稳定 |
| B、碘氧化性比氯弱 |
| C、I-的还原性比Cl-强 |
| D、溶度积Ksp(AgI)<Ksp(AgCl) |
 如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A、浓H2SO4 |
| B、饱和NaCl溶液 |
| C、浓NaOH溶液 |
| D、饱和Na2CO3 |
密闭容器中有如下反应:mA(g)+nB(g)?pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.8倍.下列说法中正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率降低 |
| C、平衡向正反应方向移动 |
| D、C的质量分数增加 |
Na2O和Na2O2的下列叙述中正确的是( )
| A、Na2O比Na2O2稳定 |
| B、均可与CO2、H2O反应产生氧气 |
| C、Na2O是淡黄色固体,而Na2O2是白色固体 |
| D、阴阳离子个数比均为1:2 |
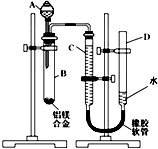 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.