题目内容
在c(Fe3+)=c(Al3+)的溶液中不断滴入NaOH溶液,滴入NaOH溶液的体积V和沉淀质量m的关系坐标图正确的是(已知某温度下Ksp[Al(OH)3]=4.6×10-33,Ksp[Fe(OH)3]=4×10-38)( )
A、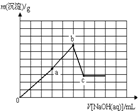 |
B、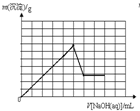 |
C、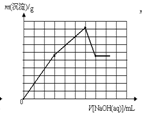 |
D、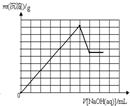 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:在c(Fe3+)=c(Al3+)的混合溶液中,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,故向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,为氢氧化铁的物质的量.据此结合图象分析.
解答:
解:在c(Fe3+)=c(Al3+)的混合溶液中,溶液中铁离子、铝离子的浓度相同,Al(OH)3的Ksp或溶解度远大于铁(OH)3,故向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,Al(OH)3+OH-═AlO2-+2H2O,在图中消耗一格氢氧化钠体积,那么开始要铝离子完全沉淀,Al3++3OH-=Al(OH)3↓,在图中消耗三格氢氧化钠体积,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,为氢氧化铁的物质的量.
故选A.
故选A.
点评:本题考查铝及化合物的性质、化学反应图象等,根据反应过程判断沉淀与氢氧化钠体积关系,注意纵坐标表示沉淀的物质的量,不是氢氧化铝.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
核糖是合成核酸的重要原料,其结构简式为:CH2OH-CHOH-CHOH-CHOH-CHO,下列关于核糖的叙述中,正确的是( )
| A、与葡萄糖互为同分异构体 |
| B、可以与银氨溶液作用形成银镜 |
| C、与葡萄糖互为同系物 |
| D、可以使石蕊试液变红 |
已知常温下:KSP[Mg(OH)2]═1.2×10-11 mol3?L-3;KSP(AgCl)═1.8×10-10 mol2?L-2;KSP(Ag2S)═6.3×10-50 mol3?L-3;KSP(CH3COOAg)═2.3×10-3mol2?L-2.下列叙述正确的是( )
| A、浓度均为0.02 mol?L-1的AgNO3和CH3COONa溶液混合一定产生CH3COOAg沉淀 |
| B、将0.1 mol/LAgNO3溶液逐滴加入到0.001mol/LKCl和0.001mol/LK2S溶液中,先产生AgCl沉淀 |
| C、要使Mg2+浓度为0.12 mol?L-1的溶液中产生Mg(OH)2的沉淀,溶液的pH≥9 |
| D、向0.1mol/L AgNO3溶液中滴加0.1mol/LNaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.则其离子方程式为:2Ag++S2-(aq)?Ag2S(s) |
固体AgCl放在较浓的KI溶液中振荡,则部分AgCl转化为AgI,原因是( )
| A、AgI比AgCl稳定 |
| B、碘氧化性比氯弱 |
| C、I-的还原性比Cl-强 |
| D、溶度积Ksp(AgI)<Ksp(AgCl) |
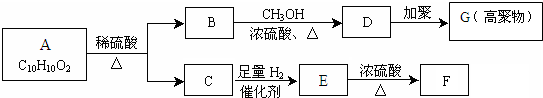
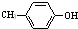 ,F能使溴的CCl4溶液褪色.请回答下列问题:
,F能使溴的CCl4溶液褪色.请回答下列问题: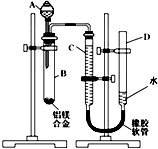 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.