题目内容
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
则△H2= .
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源.
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)=CO(g)+H2(g),
该反应的化学平衡常数表达式为K= .800℃时,将1mol CO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中各物质的浓度如下图t1前所示变化.若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将 移动(填“向左”、“向右”或“不”).t2时,若改变反应条件,导致H2浓度发生如下图t2后所示的变化,则改变的条件可能是 (填符号).
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量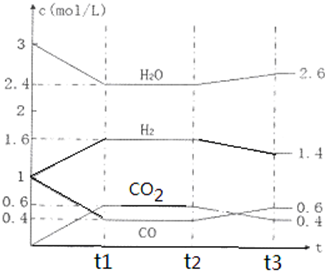
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应 .
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是 .
Ⅲ.开发新能源是解决大气污染的有效途径之一.甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如下图所示:
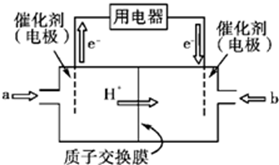
通入a气体的电极是原电池的 (填“正”或“负”),其电极反应式为 .
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
则△H2=
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源.
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s)+H2O(g)=CO(g)+H2(g),
该反应的化学平衡常数表达式为K=
a加入催化剂 b降低温度 c缩小容器体积 d减少CO2的量

(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是
Ⅲ.开发新能源是解决大气污染的有效途径之一.甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如下图所示:

通入a气体的电极是原电池的
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,化学平衡常数的含义,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:Ⅰ.依据热化学方程式和盖斯定律计算目标热化学方程式得到焓变;
Ⅱ.(1)依据化学方程式和平衡常数概念书写平衡常数;比较Qc与K大小,确定平衡移动方向,由图可知,t2时改变的条件使平衡逆向移动所致;
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动;
Ⅲ.根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应.
Ⅱ.(1)依据化学方程式和平衡常数概念书写平衡常数;比较Qc与K大小,确定平衡移动方向,由图可知,t2时改变的条件使平衡逆向移动所致;
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI;
②HI分解是可逆反应,分离出氢气有利于平衡正向移动;
Ⅲ.根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应.
解答:
解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
依据盖斯定律计算,③×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1;
故答案为:-1160kJ?mol-1;
Ⅱ.(1)C(s)+H2O(g)═CO(g)+H2(g),该反应的化学平衡常数表达式为K=
;
Qc=
<K=
,因此化学平衡向右移动;
由图可知,t2时改变的条件使平衡逆向移动所致,加催化剂和缩小容器体积对平衡无影响,减少CO2的量,平衡正向移动,降低温度,平衡逆向移动,
故答案为:
;向右;b;
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
Ⅲ.根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+.
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
依据盖斯定律计算,③×2-①得到CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1;
故答案为:-1160kJ?mol-1;
Ⅱ.(1)C(s)+H2O(g)═CO(g)+H2(g),该反应的化学平衡常数表达式为K=
| c(CO)?c(H2) |
| c(H2O) |
Qc=
| 2.6×0.6 |
| 1.4×2.4 |
| 0.6×1.6 |
| 2.4×0.4 |
由图可知,t2时改变的条件使平衡逆向移动所致,加催化剂和缩小容器体积对平衡无影响,减少CO2的量,平衡正向移动,降低温度,平衡逆向移动,
故答案为:
| c(CO)?c(H2) |
| c(H2O) |
(2)①从流程图可知,在反应器中,I2氧化SO2,生成硫酸和HI,反应方程式为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
Ⅲ.根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+.
点评:本题考查了利用盖斯定律进行反应热的计算、化学平衡常数表达式及化学平衡移动、燃料电池的原理,综合性较强,为高考常见组合形式的考题,根据元素化合价变化确定正负极发生的反应,难点是新型电池电极反应式的书写,要根据生成物、电解质特点书写电极反应式,注意:酸性条件下不能生成氢氧根离子,碱性条件下不能生成氢离子,为易错点.

练习册系列答案
相关题目
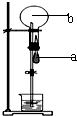 a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )
a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )| A、a-NaOH溶液、b-HCl气体 |
| B、a-NaOH溶液、b-CO2气体 |
| C、a-HCl溶液、b-NH3气体 |
| D、a-水、b-CO2气体 |
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、a点可表示MnCO3的饱和溶液,且c(Mn2+)<c(CO32-) |
| C、b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-) |
已知常温下:KSP[Mg(OH)2]═1.2×10-11 mol3?L-3;KSP(AgCl)═1.8×10-10 mol2?L-2;KSP(Ag2S)═6.3×10-50 mol3?L-3;KSP(CH3COOAg)═2.3×10-3mol2?L-2.下列叙述正确的是( )
| A、浓度均为0.02 mol?L-1的AgNO3和CH3COONa溶液混合一定产生CH3COOAg沉淀 |
| B、将0.1 mol/LAgNO3溶液逐滴加入到0.001mol/LKCl和0.001mol/LK2S溶液中,先产生AgCl沉淀 |
| C、要使Mg2+浓度为0.12 mol?L-1的溶液中产生Mg(OH)2的沉淀,溶液的pH≥9 |
| D、向0.1mol/L AgNO3溶液中滴加0.1mol/LNaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.则其离子方程式为:2Ag++S2-(aq)?Ag2S(s) |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题: 火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.
火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.