题目内容
金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性.下列关于钠的叙述中,不正确的是( )
| A、钠是银白色金属,熔点低,硬度小 |
| B、钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠 |
| C、钠不能从盐溶液中置换出相应的金属 |
| D、金属钠着火不能用水灭火 |
考点:钠的化学性质
专题:金属概论与碱元素
分析:钠为银白色金属,熔点低、硬度小,密度比水小,性质活泼,可与水发生剧烈反应生成氢氧化钠和氢气,与氧气在加热条件下反应生成过氧化钠,火焰呈黄色,以此解答该题.
解答:
解:A.钠为银白色金属,熔点低、硬度很小,可用小刀切割,故A正确;
B.钠在常温下与氧气反应生成白色的氧化钠,故B错误;
C.金属钠的活动性很强,能和盐溶液中的水反应生成钠OH,生成的NaOH能和部分盐发生复分解反应,所以不能置换出金属单质,故C正确;
D.钠与氧气反应 生成过氧化钠,过氧化钠可与水反应生成氢氧化钠和氧气,则钠失火时不能用水灭火,故D正确.
故选B.
B.钠在常温下与氧气反应生成白色的氧化钠,故B错误;
C.金属钠的活动性很强,能和盐溶液中的水反应生成钠OH,生成的NaOH能和部分盐发生复分解反应,所以不能置换出金属单质,故C正确;
D.钠与氧气反应 生成过氧化钠,过氧化钠可与水反应生成氢氧化钠和氧气,则钠失火时不能用水灭火,故D正确.
故选B.
点评:本题考查钠的性质,为高频考点,侧重于元素化合物知识综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
在298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ?mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是( )
A、Q2<
| ||
B、Q2=
| ||
C、Q2>
| ||
| D、Q1=Q2=197kJ |
科学家最近又发现了一种新能--“可燃冰”.它的主要成分是甲烷分子的结晶水合物(CH4?nH2O).其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”.这种“可燃冰”的晶体类型是( )
| A、离子晶体 | B、分子晶体 |
| C、原子晶体 | D、金属晶体 |
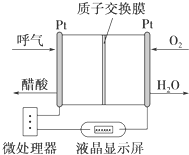 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A、电流由O2所在的铂电极经外电路流向另一电极 |
| B、O2所在的铂电极处发生还原反应 |
| C、该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
| D、微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
下列说法正确的是( )
| A、离子晶体中只存在离子键 |
| B、稀有气体形成的晶体属于分子晶体 |
| C、干冰升华时,分子内共价键会发生断裂 |
| D、由非金属元素形成的化合物一定是共价化合物 |