题目内容
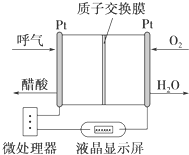 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A、电流由O2所在的铂电极经外电路流向另一电极 |
| B、O2所在的铂电极处发生还原反应 |
| C、该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
| D、微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
考点:化学电源新型电池
专题:电化学专题
分析:该装置中含有质子交换膜,则电解质溶液为酸性,酸性条件下,乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应;根据图示得出酸性燃料电池的反应物和生成物,再根据原电池原理写出该电池的反应式来判断.
解答:
解:A、乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上是氧气得电子的还原反应,电流由正极流向负极,即从O2所在的铂电极经外电路流向另一电极,故A正确;
B、乙醇燃料电池中,正极上是氧气得电子的还原反应,O2所在的铂电极处发生还原反应,故B正确;
C、该电池的负极上乙醇失电子发生氧化反应,分析装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,故C错误;
D、根据微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被测气体中酒精的含量,故D正确.
故选C.
B、乙醇燃料电池中,正极上是氧气得电子的还原反应,O2所在的铂电极处发生还原反应,故B正确;
C、该电池的负极上乙醇失电子发生氧化反应,分析装置图可知酒精在负极被氧气氧化发生氧化反应生成醋酸,CH3CH2OH-4e-+H2O=4H++CH3COOH,故C错误;
D、根据微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被测气体中酒精的含量,故D正确.
故选C.
点评:本题以乙醇为燃料考查了燃料电池,难度不大,注意正负极上电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,如果电解质溶液不同,电极反应式也不同.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
只用一种试剂可区别Na2SO4、MgCl2、NH4Cl、FeCl3四种溶液,这种试剂是( )
| A、NaOH |
| B、H2SO4 |
| C、BaCl2 |
| D、AgNO3 |
金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性.下列关于钠的叙述中,不正确的是( )
| A、钠是银白色金属,熔点低,硬度小 |
| B、钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠 |
| C、钠不能从盐溶液中置换出相应的金属 |
| D、金属钠着火不能用水灭火 |
元素周期表中ⅣA元素包括C、Si、Ce、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定.结合所学知识,判断下列反应中(反应条件略)正确的是( )
①Pb+2Cl2=PbCl4
②Sn+2Cl2=SnCl4
③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O.
①Pb+2Cl2=PbCl4
②Sn+2Cl2=SnCl4
③SnCl2+Cl2=SnCl4
④PbO2+4HCl=PbCl4+2H2O
⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O.
| A、①②④⑤ | B、①②③④ |
| C、①②③ | D、②③⑤ |
下列说法正确的是( )
| A、向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,结论:NO3-被还原为NO2 |
| B、SO2能使加了酚酞的NaOH溶液褪色,加热,溶液立即再变红色 |
| C、通过摇晃试剂瓶可区分浓硫酸和稀硫酸 |
| D、浓硝酸有强氧化性,常温下能与Fe发生反应 |
下列说法中正确的是( )
| A、原电池放电过程中,负极质量一定减轻,或正极的质量一定增加 |
| B、Fe、Cu组成原电池:Fe一定是负极 |
| C、为加快一定量的Zn与足量稀H2SO4反应的速率,且不影响生成H2总量,可加入少量CuSO4 溶液 |
| D、某海水电池总反应表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,则负极反应式:Ag-e-+Cl-=AgCl |
下列变化过程中的能量变化与其它三个不相同的是( )
| A、生石灰与水混合 |
| B、天然气燃烧 |
| C、浓硫酸溶于水 |
| D、干冰气化 |
已知:一般溶液浓度越大密度越大,氨水等例外.则体积为vL、质量为mg,浓度为a mol/L的氨水溶液的溶质质量分数为b%,用水稀释到0.5a mol/L,下列说法正确的是( )
| A、加水的体积为vL |
| B、加水的质量为mg |
| C、0.5amol/L的氨水质量分数等于0.5b% |
| D、0.5amol/L的氨水质量分数小于0.5b% |