题目内容
化学实验
(1)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 .
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(2)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 ,目的是: .
实验室制备氯气的装置如图1.
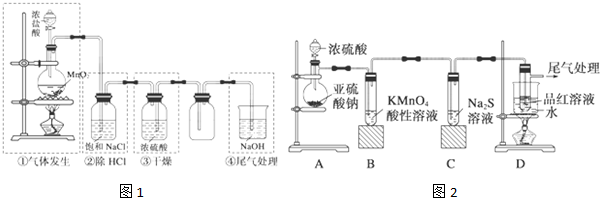
(3)装置①中发生离子反应方程式: ,
(4)①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量浓盐酸反应.所得的氯气① ②(填写<、>、=)
(5)上述装置不合理的是: (填写装置序号)
某化学兴趣小组为探究SO2的性质,按如图2所示装置进行实验.
(6)装置A中发生反应的化学方程式为 ;
(7)装置B中反应的离子方程式为 .
(1)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(2)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出
实验室制备氯气的装置如图1.

(3)装置①中发生离子反应方程式:
(4)①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量浓盐酸反应.所得的氯气①
(5)上述装置不合理的是:
某化学兴趣小组为探究SO2的性质,按如图2所示装置进行实验.
(6)装置A中发生反应的化学方程式为
(7)装置B中反应的离子方程式为
考点:氯气的实验室制法,二氧化硫的化学性质
专题:卤族元素,氧族元素
分析:(1)根据实验步骤,为将石蜡和碳酸钙溶出,可选用稀醋酸溶出碳酸钙、正己烷溶出石蜡;
(2)由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3
(3)加热条件下,实验室用浓盐酸和二氧化锰制取氯气;
(4)用含HCl146g的浓盐酸与足量的MnO2反应,理论上应生成1mol氯气,但随反应进行,浓盐酸浓度减小变稀到一定程度,不会和二氧化锰反应生成氯气,所以实际产生氯气小于1mol;用87gMnO2与足量浓盐酸反应.通过化学方程式计算可得,生成氯气为1mol;比较得出答案;
(5)根据装置进行分析;
(6)制备二氧化硫的方法是利用亚硫酸钠和浓硫酸反应生成;
(7)依据离子性质和电荷守恒,原子守恒配平书写离子方程式.
(2)由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3
(3)加热条件下,实验室用浓盐酸和二氧化锰制取氯气;
(4)用含HCl146g的浓盐酸与足量的MnO2反应,理论上应生成1mol氯气,但随反应进行,浓盐酸浓度减小变稀到一定程度,不会和二氧化锰反应生成氯气,所以实际产生氯气小于1mol;用87gMnO2与足量浓盐酸反应.通过化学方程式计算可得,生成氯气为1mol;比较得出答案;
(5)根据装置进行分析;
(6)制备二氧化硫的方法是利用亚硫酸钠和浓硫酸反应生成;
(7)依据离子性质和电荷守恒,原子守恒配平书写离子方程式.
解答:
解:(1)根据实验步骤,为将石蜡和碳酸钙溶出,因为醋酸和碳酸钙反应,稀硫酸与碳酸钙反应生成微溶的硫酸钙,可选用稀醋酸溶出碳酸钙,根据相似相容的原理,选择正己烷溶出石蜡,故选:bd;
(2)由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3,故答案为:石蜡;由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3;
(3)加热条件下,实验室用浓盐酸和二氧化锰制取氯气,二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(4)反应化学方程式为MnO2+4HCl
MnCl2+Cl2↑+2H2O;
理论计算:①含HCl146g的浓盐酸与足量的MnO2反应,4HCl~Cl2,可得氯气1mol,但随盐酸浓度变稀,溶质HCl不可能全部反应,故实际生成氯气应小于1mol;
②用87gMnO2与足量浓盐酸反应,因为浓盐酸足量,可以使87gMnO2全部反应,故生成氯气为1mol;所以②>①;故答案为:<;
(5)根据装置流程应该是制备、除杂、收集、尾气处理,其中除去水蒸气时导管应长进短出,所以不合理的是③,故答案为:③;
(6)利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(7)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;故答案为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+.
(2)由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3,故答案为:石蜡;由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3;
(3)加热条件下,实验室用浓盐酸和二氧化锰制取氯气,二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
| ||
| ||
(4)反应化学方程式为MnO2+4HCl
| ||
理论计算:①含HCl146g的浓盐酸与足量的MnO2反应,4HCl~Cl2,可得氯气1mol,但随盐酸浓度变稀,溶质HCl不可能全部反应,故实际生成氯气应小于1mol;
②用87gMnO2与足量浓盐酸反应,因为浓盐酸足量,可以使87gMnO2全部反应,故生成氯气为1mol;所以②>①;故答案为:<;
(5)根据装置流程应该是制备、除杂、收集、尾气处理,其中除去水蒸气时导管应长进短出,所以不合理的是③,故答案为:③;
(6)利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(7)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+;故答案为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+.
点评:本题考查实验室制氯气的反应原理以及二氧化硫的制取及二氧化硫的性质实验,化学方程式计算,主要考查浓度变稀后的盐酸不会与二氧化锰反应生成氯气,难度不大.

练习册系列答案
相关题目
 X、Y、Z、W有如图所示的转化关系,则X、W可能是( )
X、Y、Z、W有如图所示的转化关系,则X、W可能是( )①AlCl3、NaOH ②C、O2 ③Cl2、Fe ④S、O2.
| A、①②③ | B、①② |
| C、③④ | D、①②③④ |
只用一种试剂可区别Na2SO4、MgCl2、NH4Cl、FeCl3四种溶液,这种试剂是( )
| A、NaOH |
| B、H2SO4 |
| C、BaCl2 |
| D、AgNO3 |
能正确表示下列反应的离子方程式是( )
| A、向碳酸氢钙溶液中滴入过量澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | ||||
B、NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-
| ||||
| C、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | ||||
| D、向KIO3与KI混合溶液中加入醋酸发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性.下列关于钠的叙述中,不正确的是( )
| A、钠是银白色金属,熔点低,硬度小 |
| B、钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠 |
| C、钠不能从盐溶液中置换出相应的金属 |
| D、金属钠着火不能用水灭火 |
 )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如图:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如图:
 )互为同系物的是
)互为同系物的是 B.
B. C.
C. D.
D.
 C.2CH3CHO+H2
C.2CH3CHO+H2 中学课本中常见的几种气体:①O2 ②H2 ③CO2 ④Cl2 ⑤H2S ⑥SO2 ⑦NH3都要求掌握其实验室制法.根据所学知识回答有关问题(填气体编号)
中学课本中常见的几种气体:①O2 ②H2 ③CO2 ④Cl2 ⑤H2S ⑥SO2 ⑦NH3都要求掌握其实验室制法.根据所学知识回答有关问题(填气体编号)