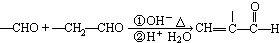题目内容
下列各图象中,不正确的是( )
A、 N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol |
B、 向弱酸HA的稀溶液中加水稀释 |
C、 有正催化剂(a)和无催化剂(b)时反应的能量变化 |
D、 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
考点:体积百分含量随温度、压强变化曲线,离子方程式的有关计算,反应热和焓变,弱电解质在水溶液中的电离平衡
专题:图示题
分析:A.从温度对反应速率的影响来分析,温度升高,反应速率大,到达平衡用的时间少,曲线的斜率大;
B.加水稀释促进弱酸的电离,二者的浓度之比可看成物质的量之比更好理解;
C.催化剂降低反应的活化能,反应速率加快,反应热不变;
D.向NH4Al(SO4)2溶液中滴加过量NaOH溶液,首先是生成Al(OH)3沉淀,当沉淀完全时,NH4+与OH-离子发生反应,之后Al(OH)3继续与OH-离子反应而溶解.
B.加水稀释促进弱酸的电离,二者的浓度之比可看成物质的量之比更好理解;
C.催化剂降低反应的活化能,反应速率加快,反应热不变;
D.向NH4Al(SO4)2溶液中滴加过量NaOH溶液,首先是生成Al(OH)3沉淀,当沉淀完全时,NH4+与OH-离子发生反应,之后Al(OH)3继续与OH-离子反应而溶解.
解答:
解:A.温度升高,反应速率增大,到达平衡用的时间少,反应曲线的斜率大,并且该反应为放热反应,升高温度平衡向逆反应方向移动,氨气的含量降低,故A错误;
B.向弱酸HA的稀溶液中加水稀释,促进弱酸的电离,平衡向正反应方向移动,则n(A-)增加,n(HA)减少,根据
可知加水稀释时
增大,故B正确;
C.催化剂降低反应的活化能,故C正确;
D.向NH4Al(SO4)2溶液中滴加过量NaOH溶液,首先发生反应为Al3++3OH-═Al(OH)3,当沉淀完全时,NH4+与OH-离子发生反应:NH4++OH-═NH3?H2O,此时沉淀的质量不变,继续加NaOH,之后Al(OH)3继续与OH-离子反应:Al(OH)3+OH-═AlO2-+2H2O,故D正确;
故选A.
B.向弱酸HA的稀溶液中加水稀释,促进弱酸的电离,平衡向正反应方向移动,则n(A-)增加,n(HA)减少,根据
| c(A-) |
| c(HA) |
| c(A-) |
| c(HA) |
C.催化剂降低反应的活化能,故C正确;
D.向NH4Al(SO4)2溶液中滴加过量NaOH溶液,首先发生反应为Al3++3OH-═Al(OH)3,当沉淀完全时,NH4+与OH-离子发生反应:NH4++OH-═NH3?H2O,此时沉淀的质量不变,继续加NaOH,之后Al(OH)3继续与OH-离子反应:Al(OH)3+OH-═AlO2-+2H2O,故D正确;
故选A.
点评:本题考查平衡移动、弱电解质的电离、化学反应与能量以及NH4Al(SO4)2与NaOH的反应,题目较为综合,难度较大,做题时注意分析图象中曲线的变化特点.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A、Mg2+、Ba2+、Cl-、NO3- |
| B、K+、AlO2-、Cl-、SO42- |
| C、Na+、K+、NO3-、HCO3- |
| D、Al3+、Cl-、CO32-、K+ |
下列做法不利于食品安全的是( )
| A、用聚氯乙烯塑料袋包装食品 |
| B、在食用盐中添加适量的碘酸钾 |
| C、在食品加工中科学使用食品添加剂 |
| D、研发高效低毒的农药,降低蔬菜的农药残留量 |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,则有关此电池推断正确的是( )
| A、通入乙烷的电极为正极 |
| B、参加反应的乙烷与氧气的物质的量之比为7:2 |
| C、负极反应式为C2H6+6H2O-→2CO32-+18H++14e- |
| D、放电一段时间后,KOH的物质的量浓度减少 |
已知,常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列叙述中正确的是( )
| A、常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B、向AgCl的悬浊液中加入0.1 mol?L-1KI溶液,沉淀可由白色转化为黄色 |
| C、将0.001 mol?L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 |
| D、向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |