题目内容
山梨酸是一种常用的食品防腐剂,如图是山梨酸的一种工业合成途径:

已知:(1)A是衡量一个国家石油化工水平的重要标准,C的分子式为C2H4O
(2)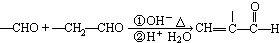
(3)
(4)RX
RCN
RCOOH
回答下列问题:
(1)E的结构简式为 ,含有官能团的名称 .
(2)G和H在一定条件下合成I的化学方程式为 ,反应类型为 .
(3)写出满足下列条件山梨酸的所有同分异构体 .
①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有-COO-结构
(4)下列说法正确的是 .
A.I可以发生加成、取代、氧化、消去反应 B.I可以和新制的氢氧化铜反应
C.1mol I完全燃烧可以消耗7mol O2 D.J和等物质的量的H2加成有两种产物.

已知:(1)A是衡量一个国家石油化工水平的重要标准,C的分子式为C2H4O
(2)
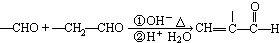
(3)

(4)RX
| NaCN |
| H+H2O |
回答下列问题:
(1)E的结构简式为
(2)G和H在一定条件下合成I的化学方程式为
(3)写出满足下列条件山梨酸的所有同分异构体
①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有-COO-结构
(4)下列说法正确的是
A.I可以发生加成、取代、氧化、消去反应 B.I可以和新制的氢氧化铜反应
C.1mol I完全燃烧可以消耗7mol O2 D.J和等物质的量的H2加成有两种产物.
考点:有机物的合成
专题:有机物的化学性质及推断
分析:A是衡量一个国家石油化工水平的重要标准,C的分子式为C2H4O,则A为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛氧化生成D为CH3COOH,D发生信息中的取代反应生成E为BrCH2COOH,E与NaCN反应得到F,F发生水解反应得到丙二酸,则F为NC-CH2COOH,C发生信息中反应生成H,结合I的结构简式可知H为CH3CH=CHCHO,据此解答.
解答:
解:A是衡量一个国家石油化工水平的重要标准,C的分子式为C2H4O,则A为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CHO,乙醛氧化生成D为CH3COOH,D发生信息中的取代反应生成E为BrCH2COOH,E与NaCN反应得到F,F发生水解反应得到丙二酸,则F为NC-CH2COOH,C发生信息中反应生成H,结合I的结构简式可知H为CH3CH=CHCHO,
(1)由上述分析可知,E的结构简式为BrCH2COOH,含有官能团的名称为:溴原子、羧基,
故答案为:BrCH2COOH;溴原子、羧基;
(2)G和H在一定条件下合成l的化学方程式为: ,反应类型为:加成反应,
,反应类型为:加成反应,
故答案为: ;加成反应;
;加成反应;
(3)满足下列条件山梨酸的所有同分异构体:①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有-COO-结构,有: ,
,
故答案为: ;
;
(4)A.I含有碳碳双键,可以发生加成、氧化,含有羟基、羧基可以发生取代反应,羟基相连碳原子相邻的碳原子上有H原子,能发生消去反应,故A正确;
B.I含有羧基,能与新制的氢氧化铜发生中和反应,故B正确;
C.I分子式为C7H10O5,可以改写为C7.5H2O,1mol I完全燃烧可以消耗7mol O2,故C正确;
D.J分J分子子内含有2个碳碳双键,和等物质的量的H2加成有三种产物,故D错误,
故答案为:ABC.
(1)由上述分析可知,E的结构简式为BrCH2COOH,含有官能团的名称为:溴原子、羧基,
故答案为:BrCH2COOH;溴原子、羧基;
(2)G和H在一定条件下合成l的化学方程式为:
 ,反应类型为:加成反应,
,反应类型为:加成反应,故答案为:
 ;加成反应;
;加成反应;(3)满足下列条件山梨酸的所有同分异构体:①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有-COO-结构,有:
 ,
,故答案为:
 ;
;(4)A.I含有碳碳双键,可以发生加成、氧化,含有羟基、羧基可以发生取代反应,羟基相连碳原子相邻的碳原子上有H原子,能发生消去反应,故A正确;
B.I含有羧基,能与新制的氢氧化铜发生中和反应,故B正确;
C.I分子式为C7H10O5,可以改写为C7.5H2O,1mol I完全燃烧可以消耗7mol O2,故C正确;
D.J分J分子子内含有2个碳碳双键,和等物质的量的H2加成有三种产物,故D错误,
故答案为:ABC.
点评:本题考查有机物推断与合成,中等难度,答题时注意对给予的信息进行利用,旨在考查学生对知识的掌握与迁移运用、思维分析等能力,注意根据有机物的结构与反应条件利用顺推法进行推断.

练习册系列答案
相关题目
下列各图象中,不正确的是( )
A、 N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol |
B、 向弱酸HA的稀溶液中加水稀释 |
C、 有正催化剂(a)和无催化剂(b)时反应的能量变化 |
D、 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 6 | 0 | 放出热量b kJ |
| ③ | 0 | 0 | 2 | 吸收热量c kJ |
| A、热量值关系一定满足:a=c<92.4 |
| B、三个容器内反应的平衡常数:③>①>② |
| C、达平衡时氨气的体积分数:①<② |
| D、N2的转化率:①>② |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )| A、对应简单离子半径:X>W>Y>Z |
| B、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
| C、X、W两元素形成的二元化合物中一定含有离子键 |
| D、对应气态氢化物的稳定性W>Y,对应气态氢化物的熔沸点Y>W |
下列物质,属于电解质的是( )
| A、氯气 | B、乙醇 |
| C、食盐 | D、烧碱溶液 |
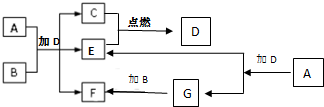 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体. 某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题: