题目内容
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g)+bB(g)?pC(g)△H=?,反应情况记录如表:
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)= mol?L-1?min-1
(2)由表中数据可知反应在第 4min 到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;
③第8min .
(3)若从开始到第4min建立平衡时反应放出的热量为235.92kJ则该反应的△H= .
(4)反应在第4min建立平衡,此温度下该反应的化学平衡常数K= .
(5)判断第9min时是否达平衡,说明理由 .
Ⅱ.已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 .
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol?L-1,B溶液中水电离出的氢离子浓度为 mol?L-1.
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为: .
| 时间/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
(1)第2min到第4min内A的平均反应速率v(A)=
(2)由表中数据可知反应在第 4min 到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min
②第6min
③第8min
(3)若从开始到第4min建立平衡时反应放出的热量为235.92kJ则该反应的△H=
(4)反应在第4min建立平衡,此温度下该反应的化学平衡常数K=
(5)判断第9min时是否达平衡,说明理由
Ⅱ.已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为
A.大于7 B.等于7 C.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
考点:化学平衡的计算,酸碱混合时的定性判断及有关ph的计算
专题:
分析:I.(1)A物质的化学反应速率v(A)=
,代入数据进行计算即可;
(2)影响化学反应速率的因素有:使用催化剂、改变温度、浓度、改变物质的表面积等;
(3)在开始到第4min建立平衡时,A物质的消耗量为0.6mol,根据化学方程式计算即可;
(4)求出第4min时各物质的浓度,根据平衡常数计算公式计算即可;
(5)根据Qc=
,计算第9min时Qc的值,与K比较;
II.(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液中氢离子和氢氧根离子恰好反应生成氯化钡溶液,溶液呈中性;
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度,B溶液中水电离出的氢离子浓度依据溶液中离子积常数计算得到;
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱.
| △c |
| t |
(2)影响化学反应速率的因素有:使用催化剂、改变温度、浓度、改变物质的表面积等;
(3)在开始到第4min建立平衡时,A物质的消耗量为0.6mol,根据化学方程式计算即可;
(4)求出第4min时各物质的浓度,根据平衡常数计算公式计算即可;
(5)根据Qc=
| c2(C) |
| c(A)?c2(B) |
II.(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液中氢离子和氢氧根离子恰好反应生成氯化钡溶液,溶液呈中性;
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度,B溶液中水电离出的氢离子浓度依据溶液中离子积常数计算得到;
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱.
解答:
解:在前2min内,各物质的浓度的变化量之比(1-0.8):(3-2.6):(0.4-0)=1:2:2,则方程式为A (g)+2B(g)?2C(g);
(1)A物质的化学反应速率v(A)=
=
=0.1mol/(l?min),故答案为:0.1;
(2)①在第0~2min内,A的物质的量减小了0.2mol,在2~4min内A的物质的量在原基础上减小了0.4mol,化学反应速率加快了,可以是使用催化剂或升高温度,
故答案为:使用催化剂、升高温度;
②第6min 到第8min,作为反应物,浓度应该是减小的趋势,但是B的物质的量从1.8mol增加到了2.0mol,所以可知一定是加入了B物质,
故答案为:增加B的浓度;
③第8min到第9min时间段内,C作为生成物,它的浓度应是增大的趋势,但是数据表明,其浓度减小了,一定是减少了C的浓度,
故答案为:减小C的浓度;
(3)根据热化学方程式,设:反应的焓变值为Q;
A(g)+2B(g) 2C(g)△H=-QkJ/mol
2C(g)△H=-QkJ/mol
1mol QkJ
0.6mol 235.92kJ
则有:Q=
=393.2 kJ?mol-1,
则△H=-393.2 kJ?mol-1,
故答案为:-393.2 kJ?mol-1;
(4)反应在第4min建立平衡,c(A)=
0.2mol/L,c(B)=
=0.9mol/L,c(C)=
=0.6mol/L,
则K=
=
=2.22;
故答案为:2.22;
(5)Qc=
=
=0.997<K=2.22,则反应未达到平衡状态;
故答案为:未平衡,因为Qc<K;
II.(1)常温下,A酸的溶液pH=a,B碱的溶液pH=b,若A为盐酸,且a=3,溶液中氢离子浓度为10-3mol/L,B为氢氧化钡是强碱,b=11溶液中氢氧根离子浓度为 10-3mol/L,两者等体积混合氢离子和氢氧根离子恰好反应生成氯化钡溶液,溶液呈中性,pH=7,
故答案为:B;
(2)若A为醋酸,且a=4,c(H+)=10-4mol/L,依据溶液中离子积常数c(H+)c(OH-)=10-14,c(H+)水=c(OH-)水=10-10mol/L,B为氢氧化钠,b=12,c(H+)水=10-12mol/L,
故答案为:10-10;10-12;
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱存在电离平衡,则混合溶液中必定是M+离子能发生水解,反应的离子方程式为:M++H2O?MOH+H+,
故答案为:M++H2O?MOH+H+.
(1)A物质的化学反应速率v(A)=
| △c |
| t |
| ||
| 2min |
(2)①在第0~2min内,A的物质的量减小了0.2mol,在2~4min内A的物质的量在原基础上减小了0.4mol,化学反应速率加快了,可以是使用催化剂或升高温度,
故答案为:使用催化剂、升高温度;
②第6min 到第8min,作为反应物,浓度应该是减小的趋势,但是B的物质的量从1.8mol增加到了2.0mol,所以可知一定是加入了B物质,
故答案为:增加B的浓度;
③第8min到第9min时间段内,C作为生成物,它的浓度应是增大的趋势,但是数据表明,其浓度减小了,一定是减少了C的浓度,
故答案为:减小C的浓度;
(3)根据热化学方程式,设:反应的焓变值为Q;
A(g)+2B(g)
 2C(g)△H=-QkJ/mol
2C(g)△H=-QkJ/mol1mol QkJ
0.6mol 235.92kJ
则有:Q=
| 235.92kJ×1mol |
| 0.6mol |
则△H=-393.2 kJ?mol-1,
故答案为:-393.2 kJ?mol-1;
(4)反应在第4min建立平衡,c(A)=
| 0.4mol |
| 2L |
| 1.8mol |
| 2L |
| 1.2mol |
| 2L |
则K=
| c2(C) |
| c(A)?c2(B) |
| 0.62 |
| 0.2×0.92 |
故答案为:2.22;
(5)Qc=
| c2(C) |
| c(A)?c2(B) |
(
| ||||
(
|
故答案为:未平衡,因为Qc<K;
II.(1)常温下,A酸的溶液pH=a,B碱的溶液pH=b,若A为盐酸,且a=3,溶液中氢离子浓度为10-3mol/L,B为氢氧化钡是强碱,b=11溶液中氢氧根离子浓度为 10-3mol/L,两者等体积混合氢离子和氢氧根离子恰好反应生成氯化钡溶液,溶液呈中性,pH=7,
故答案为:B;
(2)若A为醋酸,且a=4,c(H+)=10-4mol/L,依据溶液中离子积常数c(H+)c(OH-)=10-14,c(H+)水=c(OH-)水=10-10mol/L,B为氢氧化钠,b=12,c(H+)水=10-12mol/L,
故答案为:10-10;10-12;
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性.说明碱是弱碱存在电离平衡,则混合溶液中必定是M+离子能发生水解,反应的离子方程式为:M++H2O?MOH+H+,
故答案为:M++H2O?MOH+H+.
点评:本题主要考查了影响化学反应速率的因素和有关反应速率的计算、化学平衡常数的定义以及计算、酸碱反应后的溶液酸碱性分析判断、溶液中离子积常数的计算应用等,题目难度较大,题目综合性较强,熟练掌握基础知识是解决此类题是关键.

练习册系列答案
相关题目
下列各图象中,不正确的是( )
A、 N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol |
B、 向弱酸HA的稀溶液中加水稀释 |
C、 有正催化剂(a)和无催化剂(b)时反应的能量变化 |
D、 向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )| A、对应简单离子半径:X>W>Y>Z |
| B、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
| C、X、W两元素形成的二元化合物中一定含有离子键 |
| D、对应气态氢化物的稳定性W>Y,对应气态氢化物的熔沸点Y>W |
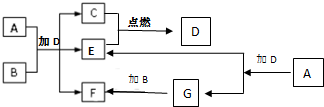 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体. 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系: