题目内容
2.下列反应能用离子方程式H++OH-═H2O来表示的是( )| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | 2HCl+Ba(OH)2═BaCl2+2H2O | ||
| C. | H2SO4+Cu(OH)2═CuSO4+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
分析 离子方程式H++OH-═H2O表示强酸与可溶性强碱溶液反应生成可溶性盐和水的一类反应,其中酸必须是强酸,不能是醋酸;碱必须是易溶物,不能是氢氧化铜;生成的盐必须是易溶物,不能为硫酸钡,据此进行判断.
解答 解:A.硫酸与氢氧化钡溶液反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,不能用H++OH-═H2O来表示,故A错误;
B.2HCl+Ba(OH)2═BaCl2+2H2O的离子方程式为H++OH-═H2O,满足条件,故B正确;
C.H2SO4+Cu(OH)2═CuSO4+2H2O的离子方程式为:Cu(OH)2+2H+=2H2O+Cu2+,不能用H++OH-═H2O来表示,故C错误;
D.醋酸与氢氧化钠溶液反应离子方程式为:CH3COOH+H+=CH3COO-+H2O,不能用H++OH-═H2O来表示,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,题目难度不大,明确离子反应的书写原则为解答关键,注意掌握离子方程式表示的意义,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.下列关于(强、弱)电解质和非电解质的叙述中,错误的是( )
| A. | 酸、碱、盐都是电解质 | |
| B. | 蔗糖、酒精是非电解质 | |
| C. | 盐酸是强电解质 | |
| D. | NH3的水溶液能导电,但NH3不是电解质 |
17.300mL 0.1mol•L-1的氯化钾溶液与100mL0.1mol•L-1 的氯化铁溶液的氯离子的物质的量的浓度之比是( )
| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
7.下列变化需要加还原剂才能实现的是( )
| A. | MnO2→MnCl2 | B. | Fe→Fe2+ | C. | Cl-→Cl2 | D. | SO2→H2SO3 |
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: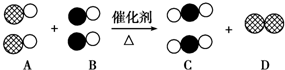
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.