题目内容
将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应.试计算:
(1)写出氯化铵与熟石灰反应的方程式.
(2)生成的氨气在标准状况下的体积是多少升?
(3)若将这些氨气配成500mL氨水,该氨水的物质的量浓度是多少? .
(1)写出氯化铵与熟石灰反应的方程式.
(2)生成的氨气在标准状况下的体积是多少升?
(3)若将这些氨气配成500mL氨水,该氨水的物质的量浓度是多少?
考点:化学方程式的有关计算
专题:
分析:(1)氯化铵固体和熟石灰混合加热生成氨气、水和氯化钙;
(2)根据方程式中定量关系计算生成氨气的体积;
(3)氨水溶质按氨气计算,根据c=
计算该氨水的物质的量浓度.
(2)根据方程式中定量关系计算生成氨气的体积;
(3)氨水溶质按氨气计算,根据c=
| n |
| V |
解答:
解:(1)氯化铵固体和熟石灰混合加热生成氨气、水和氯化钙,反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
(2)10.7g氯化铵的物质的量为
=0.2mol,则:
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2mol 44.8L
0.2mol V
所以V=
=4.48L,
故答案为:4.48;
(3)氨水溶质按氨气计算,该氨水的物质的量浓度为
=0.4mol/L,故答案为:0.4mol/.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)10.7g氯化铵的物质的量为
| 10.7g |
| 53.5g/mol |
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2mol 44.8L
0.2mol V
所以V=
| 0.2mol×44.8L |
| 2mol |
故答案为:4.48;
(3)氨水溶质按氨气计算,该氨水的物质的量浓度为
| 0.2mol |
| 0.5L |
点评:本题考查根据方程式的计算,比较基础,侧重学生对基础知识的巩固.要注意计算格式,方程式中各量应符合上下一致,左右对应即可,即g、mol、L单位对应.

练习册系列答案
相关题目
环境污染已成为人类社会面临的重大威胁,各种污染数不胜数.下列名词:
①温室效应②赤潮 ③潮汐④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦酸雨⑧大脖子病
与环境污染无关的是( )
①温室效应②赤潮 ③潮汐④光化学污染 ⑤臭氧层空洞 ⑥水俣病 ⑦酸雨⑧大脖子病
与环境污染无关的是( )
| A、①②③⑧ | B、③⑧ |
| C、①⑤⑥⑧ | D、②③⑤⑦ |
在铜锌原电池中,锌电极上发生的反应为Zn-2e-=Zn2+,则( )
| A、锌电极为负极 |
| B、锌电极为正极 |
| C、反应中Zn被氧化 |
| D、反应中Zn被还原 |
在一定温度下的恒容密闭容器中发生的可逆反应2NO2(g)?N2O4(g),下列说法不正确的是( )
| A、容器内压强不再变化,可说明达到化学平衡 |
| B、混合气体的颜色不再变化,可说明达到化学平衡 |
| C、达到平衡时,正逆反应仍然在进行 |
| D、若有2mol NO2放入密闭容器中,必生成1mol N2O4 |
在相同状况下,等物质的量的铁和铝,分别跟足量的盐酸反应,生成氢气的体积比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:4 |
 电解饱和食盐水是氯碱工业的基础.以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水.通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色.请回答:
电解饱和食盐水是氯碱工业的基础.以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水.通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色.请回答: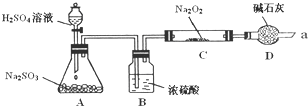 某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
