题目内容
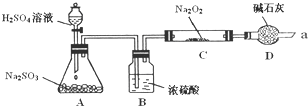 某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.
某同学想通过利用图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.实验后测得反应前C管的质量为m1 g,反应后C管的质量为m 2 g,反应后装置D质量增加了n g.请分析:
Ⅰ. 装置D的作用
Ⅱ.如何检验反应中是否有O2生成
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:
(1)若按假设2进行,反应方程式为
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:

得出结论:产物是Na2SO4.
该方案是否合理
(3)若假设2成立,则参加反应的Na2O2物质的量为
考点:探究物质的组成或测量物质的含量,含硫物质的性质及综合应用
专题:氧族元素
分析:Ⅰ、根据浓硫酸的吸水性以及二氧化硫、过氧化钠的性质来回答;
Ⅱ、用带火星的木条来检验氧气;
Ⅲ、(1)过氧化钠和二氧化硫反应生成硫酸钠;
(2)硝酸具有氧化性,能将亚硫酸钡氧化为不溶于硝酸的硫酸钡;
(3)根据化学方程式结合固体质量的差量法来计算.
Ⅱ、用带火星的木条来检验氧气;
Ⅲ、(1)过氧化钠和二氧化硫反应生成硫酸钠;
(2)硝酸具有氧化性,能将亚硫酸钡氧化为不溶于硝酸的硫酸钡;
(3)根据化学方程式结合固体质量的差量法来计算.
解答:
解:Ⅰ、浓硫酸有吸水性,能吸收二氧化硫中的水分,防止水蒸气与过氧化钠反应而干扰二氧化硫;碱石灰是干燥剂,能吸收水分,防止水蒸气的干扰;装置D中碱石灰是碱性物质,能吸收二氧化硫等酸性气体,防止污染大气,
故答案为:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,同时吸收过量的SO2,以免污染空气;
Ⅱ、用带火星的木条可检验氧气,故答案为:用带火星的木条靠近干燥管口a,观察其是否燃烧;
Ⅲ、推理法可以推出:假设3:是含有亚硫酸钠和硫酸钠的混合物,故答案为:有Na2SO3和Na2SO4;
(1)过氧化钠和二氧化硫反应生成硫酸钠的原理方程式为:Na2O2+SO2=Na2SO4,故答案为:Na2O2+SO2=Na2SO4;
(2)生成的白色沉淀中如果含有亚硫酸钡,加入硝酸后,会将之氧化为硫酸钡,不能得出结论:产物是Na2SO4,
故答案为:否;HNO3有氧化性,据此不能确定产物是Na2SO3还是Na2SO4或二者兼有;
(3)若假设2成立,过氧化钠和二氧化硫的反应为:Na2O2+SO2=Na2SO4,则(m2-m1)等于参加反应的SO2质量,则参加反应的Na2O2物质的量n(Na2O2)=
,
故答案为:
.
故答案为:防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应,同时吸收过量的SO2,以免污染空气;
Ⅱ、用带火星的木条可检验氧气,故答案为:用带火星的木条靠近干燥管口a,观察其是否燃烧;
Ⅲ、推理法可以推出:假设3:是含有亚硫酸钠和硫酸钠的混合物,故答案为:有Na2SO3和Na2SO4;
(1)过氧化钠和二氧化硫反应生成硫酸钠的原理方程式为:Na2O2+SO2=Na2SO4,故答案为:Na2O2+SO2=Na2SO4;
(2)生成的白色沉淀中如果含有亚硫酸钡,加入硝酸后,会将之氧化为硫酸钡,不能得出结论:产物是Na2SO4,
故答案为:否;HNO3有氧化性,据此不能确定产物是Na2SO3还是Na2SO4或二者兼有;
(3)若假设2成立,过氧化钠和二氧化硫的反应为:Na2O2+SO2=Na2SO4,则(m2-m1)等于参加反应的SO2质量,则参加反应的Na2O2物质的量n(Na2O2)=
| m2-m1 |
| 64 |
故答案为:
| m2-m1 |
| 64 |
点评:本题考查了常见气体的制取和实验装置的选择,主要是实验探究物质组成的实验分析判断,是一道综合知识题目,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应属于氧化还原反应的是( )
| A、盐酸和氢氧化钠溶液反应 |
| B、硫酸铜晶体受热变成白色粉末 |
| C、二氧化硫溶于水 |
| D、铁在潮湿空气中缓慢氧化 |
在反应:H2+CuO
H2O+Cu中,H2作( )
| ||
| A、还原剂 | B、氧化剂 |
| C、还原产物 | D、氧化产物 |
下列有关实验操作正确的是( )
A、 称量氢氧化钠固体 |
B、 检验铁粉与水蒸气反应产生的氢气 |
C、 配制150mL 0.10 mol?L-1盐酸 |
D、 分离两种沸点相差较大的液体互溶混合物 |
 历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的( )
历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中错误的( )| A、靛蓝由碳、氢、氧、氮四种元素组成 |
| B、它的分子式是C16H10N2O2 |
| C、该物质是高分子化合物 |
| D、它是芳香族有机物 |

 某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下:
某食盐样品中混有NaI杂质,为测定该食盐样品中NaCl的纯度,甲同学设计的实验过程如下: