题目内容
 电解饱和食盐水是氯碱工业的基础.以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水.通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色.请回答:
电解饱和食盐水是氯碱工业的基础.以下是实验室中电解饱和食盐水的装置图,A、B均为石墨电极,U形管内装有足量的饱和食盐水.通电几分钟后,将湿润的碘化钾淀粉试纸放在A电极一端的管口,试纸变蓝色.请回答:(1)A极为
(2)写出B极的电极反应式
(3)停止电解时,测得电路中共转移电子0.02mol,则标准状况下A极生成气体的体积为
(4)电解过程中溶液的pH
考点:电解原理
专题:电化学专题
分析:(1)用惰性电极电解饱和食盐水溶液,A电极湿润的淀粉碘化钾试纸变蓝色,说明A电极上生成氯气,则A电极是阳极,B电极是阴极,阳极连接电源正极,阴极连接电源负极;
(2)B电极上氢离子放电生成氢气;
(3)根据转移电子和氯气之间的关系式计算;
(4)阴极上氢离子放电,且阴极附近有氢氧根离子生成,导致溶液呈碱性.
(2)B电极上氢离子放电生成氢气;
(3)根据转移电子和氯气之间的关系式计算;
(4)阴极上氢离子放电,且阴极附近有氢氧根离子生成,导致溶液呈碱性.
解答:
解:(1)用惰性电极电解饱和食盐水溶液,A电极湿润的淀粉碘化钾试纸变蓝色,说明A电极上生成氯气,则A电极是阳极,B电极是阴极,阳极连接电源正极,所以b为负极,故答案为:阳;负;
(2)B电极上氢离子放电生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(3)A电极上电极反应式为2Cl--2e-=Cl2↑,根据方程式知,生成氯气体积=
×1×22.4L/mol=0.224L,
故答案为:0.224;
(4)电池反应式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,溶液由中性变为碱性,所以其PH增大,故答案为:增大.
(2)B电极上氢离子放电生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(3)A电极上电极反应式为2Cl--2e-=Cl2↑,根据方程式知,生成氯气体积=
| 0.02mol |
| 2 |
故答案为:0.224;
(4)电池反应式为2NaCl+2H2O
| ||
点评:本题考查了电解原理,根据淀粉碘化钾颜色变化确定阴阳极、正负极,再结合阴阳上发生的电极反应来分析解答,知道氯气的检验方法,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
以下粒子只具有氧化性的是( )
| A、Fe3+ |
| B、Fe2+ |
| C、Fe |
| D、H2 |
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A、A电极是负极 |
| B、外电路中电子由B电极通过导线流向A电极 |
| C、产物为无污染的水,属于环境友好电池 |
| D、该电池的总反应:2H2+O2═2H2O |
下列物质是电解质的是( )
| A、Fe |
| B、SO3 |
| C、K2SO4 |
| D、C12H22O11(蔗糖) |
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL b mol?L-1的硝酸溶液中,加热使其充分反应(假设硝酸只被还原成NO).下列说法正确的是( )
| A、若金属有剩余,在溶液中再滴入硫酸后,金属不再溶解 | ||
| B、若金属全部溶解后,再加入KSCN溶液,则溶液一定呈血红色 | ||
| C、若金属全部溶解,且产生336 mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-
|
在化学反应3CO+Fe2O3
2Fe+3CO2中,氧化剂为( )
| ||
| A、Fe2O3 |
| B、Fe |
| C、CO |
| D、CO2 |
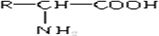 ,其分子中一定含有羧基(-COOH)和
,其分子中一定含有羧基(-COOH)和 是一种重要的合成材料,契单体的结构简式为
是一种重要的合成材料,契单体的结构简式为