题目内容
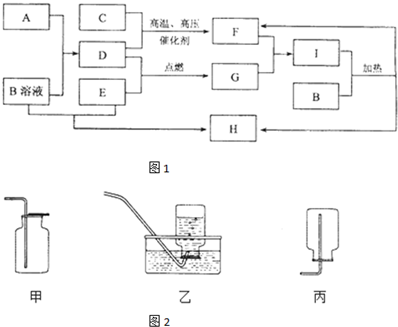
室温下,单质A为日常生活中使用最广泛的金属;单质B为黄绿色气体,单质C为常温常压下密度最小的无色气体.在合适的条件下,它们可以按如图所示进行反应,又知D溶液为黄色,E溶液为无色.

(1)写出下列物质的化学式:D ; E ; F .
(2)写出F溶液在空气中与氢氧化钠溶液反应的化学方程式: .

(1)写出下列物质的化学式:D
(2)写出F溶液在空气中与氢氧化钠溶液反应的化学方程式:
考点:无机物的推断
专题:推断题
分析:单质B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,与氯气反应得到D,D溶液为黄色,则A为Fe、D为FeCl3,单质C为常温常压下密度最小的无色气体,则C为H2,与氯气反应得到E为HCl,溶于水得到盐酸,元素与Fe反应得到F为与C(氢气),则F为FeCl2,结合物质的相关性质解答该题.
解答:
解:单质B为黄绿色气体,应为Cl2,单质A是当今世界产量最大的金属,与氯气反应得到D,D溶液为黄色,则A为Fe、D为FeCl3,单质C为常温常压下密度最小的无色气体,则C为H2,与氯气反应得到E为HCl,溶于水得到盐酸,元素与Fe反应得到F为与C(氢气),则F为FeCl2,
(1)由上述分析可知,D为FeCl3,E为HCl,F为FeCl2,
故答案为:FeCl3;HCl;FeCl2;.
(2)F溶液在空气中与氢氧钠溶液反应的化学方程式:FeCl2+2NaOH=Fe(OH)2↓+2NaCl; 4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(1)由上述分析可知,D为FeCl3,E为HCl,F为FeCl2,
故答案为:FeCl3;HCl;FeCl2;.
(2)F溶液在空气中与氢氧钠溶液反应的化学方程式:FeCl2+2NaOH=Fe(OH)2↓+2NaCl; 4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查无机物的推断,难度不大,本题注意根据物质的性质、特征作为突破口进行推断,学习中注意牢固把握元素化合物的性质,不要忽视物质的用途.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
通过复习总结,你认为下列对化学知识的理解不合理的是( )
| A、盛放氢氧化钠溶液的试剂瓶用橡皮塞,不用玻璃塞 |
| B、常温下可用铁、铝制容器盛放浓硫酸或浓硝酸,因为它们不反应 |
| C、N2和H2合成NH3,属于氮的固定 |
| D、丁达尔效应是检验胶体和溶液的一种常用方法 |
下列物质是电解质的是( )
| A、Fe |
| B、SO3 |
| C、K2SO4 |
| D、C12H22O11(蔗糖) |
某溶液中存在大量的H+、Cl-、SO42-,该溶液中还可能大量存在的是( )
| A、OH- |
| B、Ba2+ |
| C、Fe3+ |
| D、CO32- |
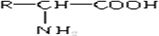 ,其分子中一定含有羧基(-COOH)和
,其分子中一定含有羧基(-COOH)和 是一种重要的合成材料,契单体的结构简式为
是一种重要的合成材料,契单体的结构简式为