题目内容
15.下列微粒中中心原子的杂化轨道类型为sp3杂化、微粒构型为V形的是( )| A. | SO32- | B. | OF2 | C. | GeBr2 | D. | CCl4 |
分析 VSEPR模型为四面体说明该微粒的价层电子对是4,价层电子对=σ 键电子对+中心原子上的孤电子对,杂化类型为sp3杂化,空间构型为V形说明该微粒中含有2个孤电子对,据此分析解答.
解答 解:A.SO32-离子中的S形成3个σ 键,孤电子对数$\frac{6+2-2×3}{2}$=1,则S杂化类型是sp3,含有一对孤对电子,微粒构型为三角锥型,故A错误;
B.OF2分子中中心原子价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,所以其中心原子氧原子采用sp3杂化,含有2个孤电子对,微粒构型为V型,故B正确;
C.GeBr2的熔沸点低,所以GeBr4是分子晶体,锗与溴形成四个共价键,价层电子对个数=4+$\frac{1}{2}$(4-4×1)=4,所以中心原子的杂化类型为sp3,不含孤电子对,微粒构型为正四面体型,故C错误;
D.CCl4中价层电子对个数=σ键个数+孤电子对个数=4+0=4,且不含孤电子对,所以CCl4为正四面体结构,故D错误;
故选B.
点评 本题考查了微粒空间构型的判断,先根据价层电子对判断VSEPR模型,去掉孤电子对就是其实际空间构型,这是高考的热点、学习的重点,题目难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
17.关于Na2CO3和NaHCO3的比较中不正确的是( )
| A. | NaHCO3比Na2CO3热稳定性差 | |
| B. | NaHCO3比Na2CO3与稀盐酸反应的速度快 | |
| C. | 在相同温度下,Na2CO3的溶解度大于NaHCO3 | |
| D. | Na2CO3能使澄清石灰水变浑浊,而NaHCO3不行 |
3.在以离子键为主的化学键中常含有共价键的成分,两种元素电负性差异越小,其共价键成分越大.下列各对原子形成的化学键中共价键成分最多的是( )
| A. | K与F | B. | Na与F | C. | Al与Cl | D. | Mg与Cl |
10.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
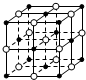

| A. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 23.4 g NaCl晶体中含有0.1NA个右图所示的结构单元 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
20.下列说法正确的是( )
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
7.下列物质的鉴别方法正确的有( )
| A. | 用硝酸银溶液区分碳酸钠和氯化钠 | |
| B. | 用硝酸钡溶液区分碳酸钠和硫酸钠 | |
| C. | 用氯化钙溶液区分碳酸钠和碳酸氢钠 | |
| D. | 用盐酸区分氢氧化钠和氯化钠 |