题目内容
10.设NA为阿伏加德罗常数的值,下列叙述错误的是( )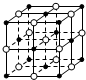
| A. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 23.4 g NaCl晶体中含有0.1NA个右图所示的结构单元 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
分析 A、求出二氧化硅的物质的量,然后根据1mol二氧化硅中含4molSi-O键来分析;
B、23.4 g NaCl的物质的量为0.4mol,根据均摊法可知图中一个晶胞含4个NaCl,据此判断;
C、一个D2O分子中含有的质子数、电子数、中子数均为10,5g D2O的物质的量为$\frac{5}{20}$mol=0.25mol,据此计算分析;
D、2 mol SO2和1 mol O2在一定条件下反应,反应方程式为2SO2+O2?2SO3,据此判断.
解答 解:A、含16 g氧原子的二氧化硅的物质的量为$\frac{16g}{32g/mol}$=0.5mol,根据1mol二氧化硅中含4molSi-Oδ键可知,0.5mol二氧化硅晶体中含有的δ键数目为2NA,故A正确;
B、质量换算物质的量,结合一个晶胞含4个NaCl,23.4 g NaCl晶体物质的量=$\frac{23.4g}{58.5g/mol}$=0.4mol;所以含0.1 NA个如图所示结构单元,故B正确;
C、一个D2O分子中含有的质子数、电子数、中子数均为10,5g D2O的物质的量为$\frac{5}{20}$mol=0.25mol,所以5 g D2O含有的质子数、电子数、中子数均为2.5NA,故C正确;
D、2 mol SO2和1 mol O2在一定条件下反应,根据反应方程式2SO2+O2?2SO3可知,所得混合气体的物质的量大于2mol小于3mol,即混合气体分子数大于2NA,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,答题时注意晶胞结构的分析及二氧化硅晶体结构的分析,难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
12.CCTV-8播放某护肤品广告,其中女星歇斯底里的吼叫:我们恨化学.著名化学人周公度教授及中国化学会先后发声,要求媒体就不当广告公开致歉并弥补损失.在你看来,下列论述,对周教授,中国化学学会无法起到支持的是( )
| A. | 化学是创造新分子和构建新物质的根本手段,我们不能“端起碗吃饭,放下碗就骂娘” | |
| B. | 化妆品是以保持人良状态为目的化学工业品或精细化工品.对于化学,化妆品无异于“空中楼阁” | |
| C. | 科学是把双刃剑,化学在给人类创造巨大财富的同时存在一些负面 影响,无可厚非,不要夸大其词,让人谈“化”色变 | |
| D. | 经济、社会的绿色发展、永续发展,不能走“先发展,后治理”的老路,要考虑、甚至优先考虑生态的可持续发展 |
18.下列变化不可能通过一步反应直接完成的是( )
| A. | Fe2O3→Fe(OH)3 | B. | Al(OH)3→Al2O3 | C. | SO3→H2SO4 | D. | Fe3+→Fe(OH)3 |
5.下列说法不正确的是( )
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
15.下列微粒中中心原子的杂化轨道类型为sp3杂化、微粒构型为V形的是( )
| A. | SO32- | B. | OF2 | C. | GeBr2 | D. | CCl4 |
20.铜与浓硫酸加热时产生SO2,是因为浓硫酸具有( )
| A. | 强酸性 | B. | 吸水性 | C. | 脱水性 | D. | 强氧化性 |