题目内容
7.同温同压下,a g甲气体和2a g乙气体所占的体积之比为1:2,根据阿伏加德罗定律判断,下列叙述不正确的是( )| A. | 同温同压下甲和乙的密度之比为1:1 | |
| B. | 等质量的甲和乙中的原子数之比为1:1 | |
| C. | 同温同体积下等质量的甲和乙的压强之比为1:1 | |
| D. | 甲与乙的相对分子质量之比为1:1 |
分析 同温同压下,a g甲气体和2a g乙气体所占的体积之比为1:2,由n=$\frac{V}{Vm}$可知甲乙两种气体的物质的量之比为1:2,结合n=$\frac{m}{M}=\frac{N}{{N}_{A}}$进行判断.
解答 解:A.A.同温同压下,气体摩尔体积相同,a g甲气体和2a g乙气体所占的体积之比为1:2,根据$ρ=\frac{m}{V}$知,其密度相同,故A正确;
B.等质量的两种气体的物质的量相同,但分子的构成未知,所以无法判断原子个数是否相同,故B错误;
C.根据PV=nRT=$\frac{m}{M}RT$知,同温同体积下等质量的甲和乙的压强之比等于其摩尔质量的反比,因为二者摩尔质量相同,所以压强相同,故C正确;
D.根据m=nM=$\frac{V}{{V}_{m}}$M知,二者的相对分子质量为1:1,故D正确,
故选B.
点评 本题考查阿伏伽德罗定律及其推论的应用,为高频考点,侧重于气体的质量、密度等物理量的考查,题目难度不大,注意把握相关计算公式的运用.

练习册系列答案
相关题目
16.已知NaHCO3溶液呈碱性,在0.1mol/L NaHCO3溶液中,下列关系正确的是( )
| A. | c(Na+)+c(H+)=c(HCO3-)+c(OH-) | B. | c(HCO3-)+c(CO32-)=0.1mol/L | ||
| C. | c(H2CO3)>c(CO32-) | D. | c(Na+)=c(H2CO3)+c(HCO3-) |
15.下列离子方程式正确的是( )
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
2.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3;
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3].
(2)为了确定产物,进行以下定性实验:
(3)为进一步确定实验Ⅰ的白色不溶物的成分,进行以下定量实验,装置如图所示:
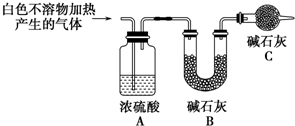
称取干燥、纯净的白色不溶物4.52g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验后装置A增重0.36g,装置B增重1.76g.
装置C的作用是防止空气中的水蒸气和CO2进入装置B中,影响实验结果;白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3;
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3].
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为氢气 |
| 实验Ⅲ | 将实验Ⅰ中的白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适量CaCl2或BaCl2稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO${\;}_{3}^{2-}$ |

称取干燥、纯净的白色不溶物4.52g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验后装置A增重0.36g,装置B增重1.76g.
装置C的作用是防止空气中的水蒸气和CO2进入装置B中,影响实验结果;白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
12.下列实验操作中正确的是( )
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 | |
| D. | 除去甲烷中混有的少量乙烯:将混合气体通入酸性KMnO4溶液中洗气 |
19.下列物质的电子式书写正确的是( )
| A. | MgCl2  | B. | CCl4  | C. | CO2  | D. | Na2O  |
16.人类已知的化合物种类最多的是( )
| A. | 第I A族元素的化合物 | B. | 第III A族元素的化合物 | ||
| C. | 第IV A族元素的化合物 | D. | 第VII A族元素的化合物 |
17.已知某无色溶液中含有SO42-、Cl-、NO3-三种阴离子,则溶液中大量存在的阳离子是( )
| A. | Ba2+ | B. | Fe3+ | C. | Ag+ | D. | Mg2+ |