题目内容
2.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学通过如下实验探究反应原理并验证产物.实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深.
(1)该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2;
猜测2:白色不溶物可能为MgCO3;
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3].
(2)为了确定产物,进行以下定性实验:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为氢气 |
| 实验Ⅲ | 将实验Ⅰ中的白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适量CaCl2或BaCl2稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO${\;}_{3}^{2-}$ |
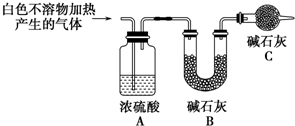
称取干燥、纯净的白色不溶物4.52g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验后装置A增重0.36g,装置B增重1.76g.
装置C的作用是防止空气中的水蒸气和CO2进入装置B中,影响实验结果;白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
分析 (1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3;
(2)依据实验Ⅱ的现象分析,镁条和碳酸氢钠溶液迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变分析出是氢气;
依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;
依据实验Ⅳ加入氯化钙生成沉淀证明含有碳酸根离子;
(3)根据B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以B不能直接与空气接触,为了防止空气中的水蒸气和CO2进入装置B中,影响实验结果,所以应连接一个干燥装置除去空气中的水蒸气和CO2;根据B中碱石灰质量的增加量就是生成的二氧化碳的质量计算出碳酸镁的质量,剩余的就是氢氧化镁的质量;
(4)根据分析、计算可知,镁与碳酸氢钠溶液反应生成Mg(OH)2•2MgCO3、碳酸钠和氢气,据此写出反应的化学方程式.
解答 解:(1)依据猜测可知白色不溶物可能是Mg(OH)2 或MgCO3或Mg(OH)2 ,MgCO3,
故答案为:Mg(OH)2 ;
(2)迅速反应,产生大量气泡和白色不溶物,可以说明镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物;气体安静燃烧、产生淡蓝色火焰,说明该气体具有可燃性,再根据质量守恒定律反应前后元素种类不变,该气体可能是氢气或一氧化碳,如果测定是一氧化碳时,燃烧后需要用到澄清石灰水,所以该气体是氢气;依据实验Ⅲ的推断分析,加入一种试剂产生气泡可知碳酸盐与酸反应产生二氧化碳,所以加入的是酸,有气泡产生,说明含有碳酸镁;加入盐酸沉淀碳酸镁全部溶解;依据实验Ⅳ加入CaCl2或BaCl2生成沉淀证明含有碳酸根离子,
故答案为:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | |||
| 实验Ⅲ | 稀盐酸 | 产生气泡沉淀全部溶解 | |
| 实验Ⅳ | CaCl2或BaCl2 |
B中碱石灰质量的增加量就是生成的二氧化碳的质量,所以生成二氧化碳的质量为8.8g,设生成8.8g二氧化碳,需要碳酸镁的质量为X则:
MgCO3+2HCl═MgCl2+H2O+CO2↑
84 44
X 8.8g
根据:$\frac{84}{44}$=$\frac{x}{8.8}$
解得X=16.8g,所以含有氢氧化镁质量为:22.6g-16.8g=5.8g;
碳酸镁和氢氧化镁物质的量之比为:$\frac{16.8g}{84g/mol}$:$\frac{5.8g}{58g/mol}$=0.2:0.1=2:1,白色不溶物的化学式为Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2,
故答案为:防止空气中的水蒸气和CO2进入装置B中,影响实验结果;Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 ;
(4)根据以上分析可知,镁与饱和碳酸氢钠溶液反应生成2Mg(OH)2•2MgCO3沉淀、Na2CO3和H2,反应的化学方程式为:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑,
故答案为:3Mg+4NaHCO3+2H2O=Mg(OH)2•2MgCO3↓+2Na2CO3+3H2↑.
点评 本题难度较大,考查全面,从定性和定量两个方面测定物质的种类,关键在于知道碳酸根离子与酸反应能产生二氧化碳,镁和氢离子反应生成氢气,题目难度较大.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案★还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬.
具体流程如下:

有关离子完全沉淀的pH如表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
★电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O${\;}_{7}^{2-}$发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-;.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
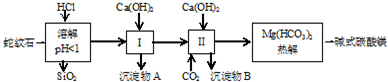
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入过量NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)Mg(HCO3)2热分解的反应方程式为:2 Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$Mg2(OH)2CO3+3CO2↑+H2O.若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数降低(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量为142).
(5)上述实验中,可以循环使用的物质是CO2(填写物质化学式).
(6)除去MgCl2酸性溶液中的Fe3+,可在加热、搅拌的条件下加入MgO或Mg(OH)2或MgCO3(试剂自选),过滤后再加入适量盐酸.
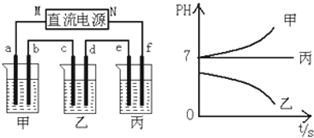
| A. | 同温同压下甲和乙的密度之比为1:1 | |
| B. | 等质量的甲和乙中的原子数之比为1:1 | |
| C. | 同温同体积下等质量的甲和乙的压强之比为1:1 | |
| D. | 甲与乙的相对分子质量之比为1:1 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生的气体可在空气中燃烧 |
| (C)剧烈反应,产生可燃性气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞的试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(1)实验的目的验证第三周期金属元素的金属性的递变规律;
(2)实验内容:与实验方案1-5对应的实验现象依次为E、A、C、B、D(填:字母编号);实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红;
(3)实验结论同周期从左到右元素的金属性逐渐减弱.
①

②

③

④

| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |