题目内容
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量(同时生成气态水),则该反应的热化学方程式为
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池.其电池总反应为:V3++VO2++H2O
| 充电 |
| 放电 |
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
①该反应的化学平衡常数表达式为K=
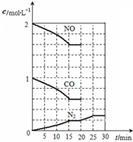
②若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将
“向右”或“不”).
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
A.加入催化剂 B.降低温度C.缩小容器体积 D.增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为
考点:化学平衡的计算,热化学方程式,化学平衡的影响因素
专题:
分析:(1)写出一氧化氮与甲烷反应的方程式,然后根据热化学方程式的书写方法写出该热化学方程式;
(2)根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析;
(3)依据平衡常数概念写出该反应的平衡常数表达式,然后通过列式计算,依据浓度商和平衡常数比较分析判断;根据影响化学平衡的因素判断改变的条件;
(4)根据催化剂的特点可知另一个反应一定实现Fe3+→Fe2+,据此写出另一个反应的离子方程式.
(2)根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析;
(3)依据平衡常数概念写出该反应的平衡常数表达式,然后通过列式计算,依据浓度商和平衡常数比较分析判断;根据影响化学平衡的因素判断改变的条件;
(4)根据催化剂的特点可知另一个反应一定实现Fe3+→Fe2+,据此写出另一个反应的离子方程式.
解答:
解:(1)还原1molNO约放出451.7kJ的热量,则消耗6molNO放热的热量为27110.2kJ,则该反应的热化学方程式为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ?mol-1,
故答案为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ?mol-1;
(2)依据电极原理分析,充电过程中,H+向阴极区移动;
反应中VO2+离子化合价降低,被还原,应是电源的正极反应,V2+离子被氧化,应是电源的负极,电极反应为:V3++e-=V2+,
故答案为:阴极区;V3++e-=V2+;
(3)①反应2NO(g)+2CO(g)?N2(g)+2CO2(g)的平衡常数表达式为:K=
,
故答案为:
;
②依据图象可知,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该温度下该反应的平衡常数为:K=
=
=0.035,
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则各组分浓度分别为:c(NO)=1.6mol/L、c(CO)=0.6mol/L+0.6mol/L=1.2mol/L、c(N2)=0.2mol/L+0.6mol/L=0.8mol/L、c(CO2)=0.4mol/L,Qc=
=
=0.035=K,则化学平衡不动,
故答案为:不;
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,所以B正确,
故答案为:B;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2═2Fe2++SO42-+4H+,通过该反应,吸收了大气污染物SO2,同时制得了硫酸,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
故答案为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ?mol-1;
(2)依据电极原理分析,充电过程中,H+向阴极区移动;
反应中VO2+离子化合价降低,被还原,应是电源的正极反应,V2+离子被氧化,应是电源的负极,电极反应为:V3++e-=V2+,
故答案为:阴极区;V3++e-=V2+;
(3)①反应2NO(g)+2CO(g)?N2(g)+2CO2(g)的平衡常数表达式为:K=
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
故答案为:
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
②依据图象可知,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该温度下该反应的平衡常数为:K=
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| 0.2×0.42 |
| 0.62×1.62 |
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则各组分浓度分别为:c(NO)=1.6mol/L、c(CO)=0.6mol/L+0.6mol/L=1.2mol/L、c(N2)=0.2mol/L+0.6mol/L=0.8mol/L、c(CO2)=0.4mol/L,Qc=
| c(N2)?c2(CO2) |
| c2(NO)?c2(CO) |
| 0.8×0.42 |
| 1.62×1.22 |
故答案为:不;
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,所以B正确,
故答案为:B;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2═2Fe2++SO42-+4H+,通过该反应,吸收了大气污染物SO2,同时制得了硫酸,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
点评:本题考查了化学平衡的计算、热化学方程式书写及原电池、电解池原理的应用,平衡移动方向判断、反应离子方程式的书写方法等知识,题目难度中等,注意掌握化学平衡及其影响因素,明确化学平衡常数的概念及表达式,能够根据平衡常数及浓度熵判断平衡状态.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
化学无处不在,下列与化学有关说法正确的是( )
| A、中性溶液的PH都相等 | ||||
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 | ||||
C、
| ||||
| D、△H<0,△S<0的化学反应不能自发进行 |
溴是海水中重要的非金属元素,地球上90%的溴元素以Br-的形式存在于海水中,所以人们称溴为“海洋元素”,下列有关说法中正确的是(( )
| A、从海水中提取溴时,不涉及氧化还原反应 |
| B、苯与溴水反应生成溴苯 |
| C、可以用CCl4萃取溴水中的溴 |
| D、向FeBr2溶液中通入Cl2时,一定会发生如下反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
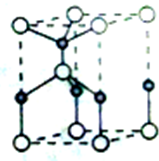 利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为
利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为



 、
、 、
、 、
、