题目内容
化学无处不在,下列与化学有关说法正确的是( )
| A、中性溶液的PH都相等 | ||||
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 | ||||
C、
| ||||
| D、△H<0,△S<0的化学反应不能自发进行 |
考点:盐类水解的应用,核素,反应热和焓变
专题:
分析:A.水的电离和温度有关,中性溶液pH大小和温度有关;
B.高铁酸钠中铁为最高价,具有强氧化性,铁离子水解生成胶体,具有吸附性;
C.同位素是同种元素的不同原子之间的互称;
D.反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.
B.高铁酸钠中铁为最高价,具有强氧化性,铁离子水解生成胶体,具有吸附性;
C.同位素是同种元素的不同原子之间的互称;
D.反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行.
解答:
解:A.水的电离和温度有关,温度升高,水的电离程度增大,中性溶液pH减小,故A错误;
B.高铁酸钠中铁为最高价,具有强氧化性,能杀灭细菌,另一个原因可能是高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水,故B正确;
C.同位素是同种元素的不同原子之间的互称,127I为原子,131I2为单质,故C错误;
D.若△H<0,△S<0,依据△H-T△S分析判断,低温时可自发进行,故D错误;
故选B.
B.高铁酸钠中铁为最高价,具有强氧化性,能杀灭细菌,另一个原因可能是高铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水,故B正确;
C.同位素是同种元素的不同原子之间的互称,127I为原子,131I2为单质,故C错误;
D.若△H<0,△S<0,依据△H-T△S分析判断,低温时可自发进行,故D错误;
故选B.
点评:本题考查了水的电离、氧化还原反应的应用、同位素、反应进行的方向等,较简单.注意水的电离和温度有关.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案
相关题目
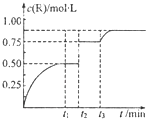 一定温度下,将1molN气体充入2L恒容密闭容器中,发生反应:M(g)+N(g)?xR(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体R的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molN气体充入2L恒容密闭容器中,发生反应:M(g)+N(g)?xR(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体R的浓度随时间变化如图所示.下列说法正确的是( )| A、该反应方程式中:x=1 |
| B、t1~t3间该反应的平衡常系数均为4 |
| C、t2时刻改变的条件是使用催化剂 |
| D、t3时刻改变的条件是移去少量Q |
碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃(不考虑反异构和立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在 5L密闭容器中进行,30秒后,NO的物质的量增加了0.3mol,则此反应的平均速率v(x)(表示反应物的消耗速率或生成物的生成速率)为( )
| A、v (O2)=0.0l mol?L-1?s-1 |
| B、v (NO)=0.001 mol?L-1?s-1 |
| C、v (NH3)=0.001 mol?L-1?s-1 |
| D、v (H2O)=0.003 mol?L-1?s-1 |
下列物质中属于非电解质的是( )
| A、H2 |
| B、氨水 |
| C、CO2 |
| D、H2SO4 |
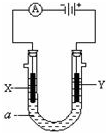
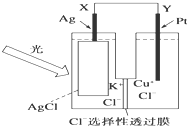 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)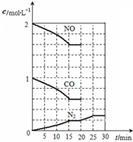 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.