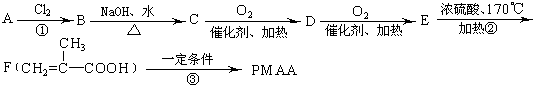
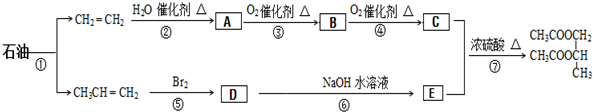
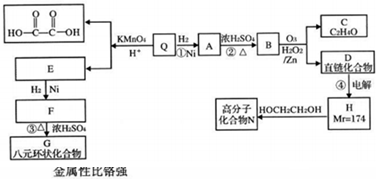
题目内容
A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B原子最外层电子数与核外电子总数之比为3:4;D原子最外层电子数与次外层电子数之比为3:4;E-、C+、A+离子的半径逐渐减小;化合物AE常温下为气体.据此回答:
(1)D、E的最高价氧化物对应水化物酸性较强的是 (写出化学式).
(2)写出A、B、两元素原子按个数比为1:1形成的共价化合物的电子式 .
(3)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2mol电子通过时两极产生的气体在标准状况下的体积共为 L,并写出电解反应方程式 .
(4)写出实验室制取E2的化学反应方程式 .
(5)写出B、C两种元素组成的化合物在潜水艇中做供氧剂时发生的化学反应方程式 .
(1)D、E的最高价氧化物对应水化物酸性较强的是
(2)写出A、B、两元素原子按个数比为1:1形成的共价化合物的电子式
(3)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2mol电子通过时两极产生的气体在标准状况下的体积共为
(4)写出实验室制取E2的化学反应方程式
(5)写出B、C两种元素组成的化合物在潜水艇中做供氧剂时发生的化学反应方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B的最外层电子数与核外电子总数之比为3:4,短周期元素内层电子数为2或10,令B元素的最外层电子数为x,则x:(x+2)=3:4,x=6或x:(10+x)=3:4,x=30,不存在,故B为氧元素;D的最外层电子数与次外层电子数之比为3:4,短周期次外层电子数为2或8,D的次外层电子数只能为8,故D有3个电子层,最外层电子数为6,D为硫元素;E原子序数最大,为主族元素,则E为Cl元素;E-、C+、A+的半径逐渐减小,C、A形成+1价离子,处于第ⅠA族,常温下化合物AE为气体,故A为氢元素,C的原子序数等于氧元素,则C为Na元素,据此答题.
解答:
解:A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B的最外层电子数与核外电子总数之比为3:4,短周期元素内层电子数为2或10,令B元素的最外层电子数为x,则x:(x+2)=3:4,x=6或x:(10+x)=3:4,x=30,不存在,故B为氧元素;D的最外层电子数与次外层电子数之比为3:4,短周期次外层电子数为2或8,D的次外层电子数只能为8,故D有3个电子层,最外层电子数为6,D为硫元素;E原子序数最大,为主族元素,则E为Cl元素;E-、C+、A+的半径逐渐减小,C、A形成+1价离子,处于第ⅠA族,常温下化合物AE为气体,故A为氢元素,C的原子序数等于氧元素,则C为Na元素,
(1)非金属性Cl>S,非金属性越强最高价含氧酸酸性越强,故酸性HClO4>H2SO4,
故答案为:HClO4;
(2)A、B、两元素原子按个数比为1:1形成的共价化合物为双氧水,它的电子式为 ,
,
故答案为: ;
;
(3)用惰性电极电解化合物NaCl的饱和溶液,阴极反应为:2Cl--2e-=Cl2↑,阳极为2H++2e-=H2↑,电解的反应方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当电路中有O.2mol电子通过时,生成气体共0.2mol,体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(4)实验室用二氧化锰和浓盐酸加热,制取氯气,化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(5)过氧化钠在潜水艇中做供氧剂时发生的化学反应方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
(1)非金属性Cl>S,非金属性越强最高价含氧酸酸性越强,故酸性HClO4>H2SO4,
故答案为:HClO4;
(2)A、B、两元素原子按个数比为1:1形成的共价化合物为双氧水,它的电子式为
 ,
,故答案为:
 ;
;(3)用惰性电极电解化合物NaCl的饱和溶液,阴极反应为:2Cl--2e-=Cl2↑,阳极为2H++2e-=H2↑,电解的反应方程式为2NaCl+2H2O
| ||
故答案为:4.48;2NaCl+2H2O
| ||
(4)实验室用二氧化锰和浓盐酸加热,制取氯气,化学方程式为MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(5)过氧化钠在潜水艇中做供氧剂时发生的化学反应方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评:本题考查了元素周期律、电子式、氯碱工业、氯气的实验室制备等知识,中等难度,解题的关键是元素的推断,答题时注意化学用语的正确使用.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列物质中属于非电解质的是( )
| A、H2 |
| B、氨水 |
| C、CO2 |
| D、H2SO4 |
用NA代表阿伏加德罗常数,相关说法不正确的是( )
| A、13.5 g Al与足量盐酸反应生成H2的分子数为NA |
| B、标准状况下,2.24 L CH4所含电子数为NA |
| C、500 mL 1 mol?L-1的K2SO4溶液中含有K+数目为NA |
| D、0.5 mol O2和0.5 mol O3的混合物所含有的氧原子个数为2.5NA |
下列说法中正确的是( )
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
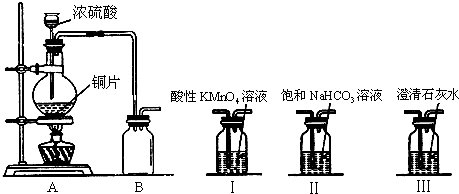
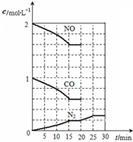 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.