��Ŀ����
���ײ��϶������ѣ�TiO2�����������Ĵ�����
��ҵ�϶������ѵ��Ʊ�������
�ٽ������Ľ��ʯ����Ҫ�ɷ�ΪTiO2����Ҫ����SiO2����̼�ۻ��װ���Ȼ�¯�У��ڸ�����ͨ��Cl2��Ӧ���Ƶû���SiCl4���ʵ�TiCl4���ڽ�SiCl4���룬�õ�������TiCl4��
����TiCl4�м�ˮ�����ȣ�ˮ��õ�����TiO2?xH2O����TiO2?xH2O���·ֽ�õ�TiO2��
��1���������Ͽ�Ƭ����Ϣ�жϣ�TiCl4��SiCl4�ڳ����µ�״̬�� �������������ȡ�IJ��������� ��
��2�����з�Ӧ�Ļ�ѧ����ʽ�� ��
��3��������ʵ������ɣ�Ӧ��TiO2?xH2O����ͼ1�� �����������ƣ��м��ȣ�
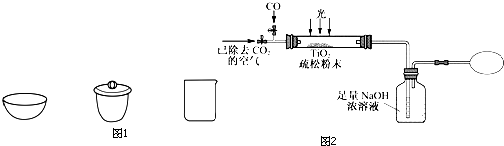
�ݱ������ܡ��Է������ġ���̬��·����������ʱ����һ������TiO2��TiO2��̫������������ĵ��ӱ�������ˮ�е�����ã�����H2O2������̴������£�
a��O2-��2O������b��O+H2O-��2OH������c��OH+OH-��H2O2
��4��H2O2�����·������е�CxHy��CO�ȣ���Ҫ��������H2O2�� ��������ԡ���ԭ�ԡ�����
��ij�о���ѧϰС����ͼ2װ��ģ�⡰��̬��·�����CO��ԭ�������г�װ������ȥ��
��5��������ͨ��22.4L��������ɱ�״����CO���壬���NaOH��Һ����16.5g����CO��ת����Ϊ
��6����CO����ȫ��ͨ���Ҫͨһ�����������Ŀ���� ��
| ���Ͽ�Ƭ | ||
| ���� | �۵�/�� | �е�/�� |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
�ٽ������Ľ��ʯ����Ҫ�ɷ�ΪTiO2����Ҫ����SiO2����̼�ۻ��װ���Ȼ�¯�У��ڸ�����ͨ��Cl2��Ӧ���Ƶû���SiCl4���ʵ�TiCl4���ڽ�SiCl4���룬�õ�������TiCl4��
����TiCl4�м�ˮ�����ȣ�ˮ��õ�����TiO2?xH2O����TiO2?xH2O���·ֽ�õ�TiO2��
��1���������Ͽ�Ƭ����Ϣ�жϣ�TiCl4��SiCl4�ڳ����µ�״̬��
��2�����з�Ӧ�Ļ�ѧ����ʽ��
��3��������ʵ������ɣ�Ӧ��TiO2?xH2O����ͼ1��

�ݱ������ܡ��Է������ġ���̬��·����������ʱ����һ������TiO2��TiO2��̫������������ĵ��ӱ�������ˮ�е�����ã�����H2O2������̴������£�
a��O2-��2O������b��O+H2O-��2OH������c��OH+OH-��H2O2
��4��H2O2�����·������е�CxHy��CO�ȣ���Ҫ��������H2O2��
��ij�о���ѧϰС����ͼ2װ��ģ�⡰��̬��·�����CO��ԭ�������г�װ������ȥ��
��5��������ͨ��22.4L��������ɱ�״����CO���壬���NaOH��Һ����16.5g����CO��ת����Ϊ
��6����CO����ȫ��ͨ���Ҫͨһ�����������Ŀ����
���㣺����ʵ�鷽�������,���������������Ⱦ������
ר�⣺
��������1���������Ͽ�Ƭ�е�TiCl4��SiCl4�۵㡢�е��ж�TiCl4��SiCl4�ڳ����µ�״̬������е����ϴ�Ļ���Һ�峣��ȡ������
��2������Ϣ��֪TiCl4��ˮ�ڼ��������£�ˮ��õ�����TiO2?xH2O��HCl��
��3�����·ֽ�������ʳ��������н��У�
��4��CxHy��CO�Ⱦ��л�ԭ�ԣ�H2O2����ǿ�����ԣ�
III����5��NaOH��Һ����16.5gΪ���յ�CO2����������̼Ԫ���غ��֪��ת���ʵ�CO�����ʵ�������CO2�����ʵ���Ϊ=
=0.375mol������ת���ʸ������õ���
��6��װ�����в����Ķ�����̼���壬ͨһ�������Ŀ���ǸϾ�װ���� �Ķ�����̼�������������գ����ٲⶨ��
��2������Ϣ��֪TiCl4��ˮ�ڼ��������£�ˮ��õ�����TiO2?xH2O��HCl��
��3�����·ֽ�������ʳ��������н��У�
��4��CxHy��CO�Ⱦ��л�ԭ�ԣ�H2O2����ǿ�����ԣ�
III����5��NaOH��Һ����16.5gΪ���յ�CO2����������̼Ԫ���غ��֪��ת���ʵ�CO�����ʵ�������CO2�����ʵ���Ϊ=
| 16.5g |
| 44g/mol |
��6��װ�����в����Ķ�����̼���壬ͨһ�������Ŀ���ǸϾ�װ���� �Ķ�����̼�������������գ����ٲⶨ��
���
�⣺I����1���������Ͽ�Ƭ�е�TiCl4��SiCl4�۵㡢�е��֪��TiCl4��SiCl4�ڳ����µ�״̬��Һ̬������е����ϴ�Ļ���Һ�峣��ȡ������
�ʴ�Ϊ��Һ̬������
��2������Ϣ��֪TiCl4��ˮ�ڼ��������£�ˮ��õ�����TiO2?xH2O��HCl����Ӧ����ʽΪ��TiCl4+��x+2��H2O
TiO2?xH2O��+4HCl��
�ʴ�Ϊ��TiCl4+��x+2��H2O
TiO2?xH2O��+4HCl��
��3���ձ���������ͨ������Һ̬���ȣ����·ֽ�������ʳ��������н��У�
�ʴ�Ϊ��������
II����4��CxHy��CO�Ⱦ��л�ԭ�ԣ�H2O2����ǿ�����ԣ�H2O2������CxHy��CO�ȣ����·������е�CxHy��CO�ȣ��ʴ�Ϊ�������ԣ�
III����5����22.4L��������ɱ�״����CO��������ʵ���Ϊ
=1mol��
NaOH��Һ����16.5gΪ���յ�CO2����������̼Ԫ���غ��֪��ת���ʵ�CO�����ʵ�������CO2�����ʵ���Ϊ=
=0.375mol��
����CO��ת����Ϊ
��100%=37.5%��
�ʴ�Ϊ��37.5%��
��6��װ�����в�����CO2���壬ͨһ�����������������װ���е�CO2�����ų�����NaOH��Һ���գ���С��
�ʴ�Ϊ����������װ���е�CO2�����ų�����NaOH��Һ���գ���С��
�ʴ�Ϊ��Һ̬������
��2������Ϣ��֪TiCl4��ˮ�ڼ��������£�ˮ��õ�����TiO2?xH2O��HCl����Ӧ����ʽΪ��TiCl4+��x+2��H2O
| ||
�ʴ�Ϊ��TiCl4+��x+2��H2O
| ||
��3���ձ���������ͨ������Һ̬���ȣ����·ֽ�������ʳ��������н��У�
�ʴ�Ϊ��������
II����4��CxHy��CO�Ⱦ��л�ԭ�ԣ�H2O2����ǿ�����ԣ�H2O2������CxHy��CO�ȣ����·������е�CxHy��CO�ȣ��ʴ�Ϊ�������ԣ�
III����5����22.4L��������ɱ�״����CO��������ʵ���Ϊ
| 22.4L |
| 22.4L/mol |
NaOH��Һ����16.5gΪ���յ�CO2����������̼Ԫ���غ��֪��ת���ʵ�CO�����ʵ�������CO2�����ʵ���Ϊ=
| 16.5g |
| 44g/mol |
����CO��ת����Ϊ
| 0.375mol |
| 1mol |
�ʴ�Ϊ��37.5%��
��6��װ�����в�����CO2���壬ͨһ�����������������װ���е�CO2�����ų�����NaOH��Һ���գ���С��
�ʴ�Ϊ����������װ���е�CO2�����ų�����NaOH��Һ���գ���С��
���������⿼��ѧ���Ķ���Ŀ��ȡ��Ϣ���������ʷ����ᴿ�Ȼ�����������ʵ��ԭ��װ�õ�����ȣ��Ѷ��еȣ�Ҫ��ѧ��Ҫ����ʵ��ʵ�����֪ʶ�����Ӧ����Ϣ������֪ʶ��������������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
���б仯�У����ڷ��ȷ�Ӧ���ǣ�������
| A��H2O��g���TH2O��l����H=-44kJ/mol |
| B��2HI��g���TH2��g��+I2��g����H=+14.9kJ/mol |
C��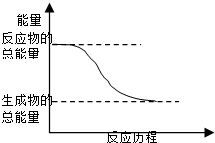 �����仯��ͼ��ʾ�Ļ�ѧ��Ӧ |
| D���γɻ�ѧ��ʱ�ų������Ļ�ѧ��Ӧ |
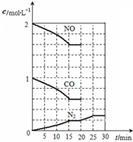 ���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����
���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ����� �������IJ�ҵ���������ɡ���������ȡ������ұ�������ļӹ��Ȼ��ڹ��ɣ���ش��������⣺
�������IJ�ҵ���������ɡ���������ȡ������ұ�������ļӹ��Ȼ��ڹ��ɣ���ش��������⣺