题目内容
化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基.Ⅰ可以用E和H在一定条件下合成,途径如图所示:

已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R-CH=CH2
R-CH2CH2OH
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.

回答下列问题:
(1)A的结构简式为 ;
(2)指出下列反应类型A→B ,F→G ;
(3)D新制Cu(OH)2反应的化学方程式为 ;
(4)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件,共有 种(不考虑立体异构).写出任意两种的结构简式 、 .
①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;
②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2.

已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R-CH=CH2
| ①B2H6 |
| ②H2O2/OH- |
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.

回答下列问题:
(1)A的结构简式为
(2)指出下列反应类型A→B
(3)D新制Cu(OH)2反应的化学方程式为
(4)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件,共有
①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;
②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2.
考点:有机物的推断
专题:有机物的化学性质及推断
分析:A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应生成B为CH2=C(CH3)2,B发生信息2中的反应生成C为(CH3)2CHCH2OH,C发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E为(CH3)2CHCOOH.
F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链且处于对位,则F为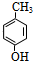 ,F与氯气在光照条件下发生取代反应生成G为
,F与氯气在光照条件下发生取代反应生成G为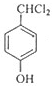 ,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为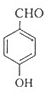 ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为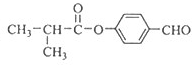 ,据此解答.
,据此解答.
F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链且处于对位,则F为
 ,F与氯气在光照条件下发生取代反应生成G为
,F与氯气在光照条件下发生取代反应生成G为 ,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为 ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为 ,据此解答.
,据此解答.解答:
解:A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应生成B为CH2=C(CH3)2,B发生信息2中的反应生成C为(CH3)2CHCH2OH,C发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E为(CH3)2CHCOOH.
F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链且处于对位,则F为 ,F与氯气在光照条件下发生取代反应生成G为
,F与氯气在光照条件下发生取代反应生成G为 ,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为 ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为 ,
,
(1)由上述分析可知,A为(CH3)3CCl,故答案为:(CH3)3CCl;
(2)由上述分析可知,A→B属于消去反应,F→G属于取代反应,故答案为:消去反应;取代反应;
(3)D的结构简式为(CH3)2CHCHO,与新制氢氧化铜反应方程式为: ,
,
故答案为: ;
;
(4)I( )的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;
)的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;
②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体含有-CHO、-COOH,结合①
可知2个不同的取代基处于对位,
侧链为-CHO、-CH2CH2COOH,侧链为-CH2CHO、-CH2COOH,侧链为-CH2CH2CHO、-COOH,侧链为-CHO、-CH(CH3)COOH,侧链为-CH(CH3)CHO、-COOH,侧链为-CH3、-CH(CHO)COOH,对应的结构简式为: ,故符合条件的同分异构体有6种,任意2种同分异构体结构简式为:,
,故符合条件的同分异构体有6种,任意2种同分异构体结构简式为:,
故答案为:6.
J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,故产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,故符合条件的同分异构体结构简式为: 、
、 等,
等,
故答案为:6; 、
、 .
.
F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链且处于对位,则F为
 ,F与氯气在光照条件下发生取代反应生成G为
,F与氯气在光照条件下发生取代反应生成G为 ,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为 ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为 ,
,(1)由上述分析可知,A为(CH3)3CCl,故答案为:(CH3)3CCl;
(2)由上述分析可知,A→B属于消去反应,F→G属于取代反应,故答案为:消去反应;取代反应;
(3)D的结构简式为(CH3)2CHCHO,与新制氢氧化铜反应方程式为:
 ,
,故答案为:
 ;
;(4)I(
 )的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;
)的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,且苯环上的一氯取代物只有两种;②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体含有-CHO、-COOH,结合①
可知2个不同的取代基处于对位,
侧链为-CHO、-CH2CH2COOH,侧链为-CH2CHO、-CH2COOH,侧链为-CH2CH2CHO、-COOH,侧链为-CHO、-CH(CH3)COOH,侧链为-CH(CH3)CHO、-COOH,侧链为-CH3、-CH(CHO)COOH,对应的结构简式为:
 ,故符合条件的同分异构体有6种,任意2种同分异构体结构简式为:,
,故符合条件的同分异构体有6种,任意2种同分异构体结构简式为:,故答案为:6.
J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,故产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,故符合条件的同分异构体结构简式为:
 、
、 等,
等,故答案为:6;
 、
、 .
.
点评:本题考查有机物推断,需要对给予的信息进行利用,能较好的考查学生自学能力,熟练掌握官能团的性质与转化,再结合反应条件利用正推法推断,(4)中同分异构体的书写是易错点、难点,根据信息确定苯环侧链是关键,难点中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
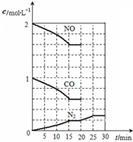 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.