题目内容
下表是50mL稀硫酸与0.10g某金属反应的实验数据:分析上述数据,回答下列问题:
(1)实验2和3表明, 对反应速率有影响.结论: ,反应速率越快.
(2)实验4中“?”处的温度分别是 ℃.
(3)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号).
(4)本实验中影响反应速率的其他因素还有 ,其实验序号是 .
| 实验序号 | 金属 状态 | c(H2SO4) /mol?L-1 | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 丝 | 0.7 | 20 | 36 | 250 |
| 2 | 丝 | 0.8 | 20 | 35 | 200 |
| 3 | 粉末 | 0.8 | 20 | 35 | 25 |
| 4 | 丝 | 1.0 | ? | 35 | 125 |
| 5 | 丝 | 1.0 | 35 | 50 | 50 |
(2)实验4中“?”处的温度分别是
(3)仅表明反应物浓度对反应速率产生影响的实验有
(4)本实验中影响反应速率的其他因素还有
考点:化学反应速率的影响因素
专题:
分析:影响化学反应速率的因素很多:
固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率降低;
反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;
反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低.
固体颗粒的大小,在其他条件相同时,固体颗粒越小,反应物的表面积越大,化学反应速率越快;固体颗粒越小,固体反应物的表面积越小,化学反应速率降低;
反应物的浓度,在其他条件相同时,增大反应物的浓度,化学反应速率加快;减小反应物的浓度,反应速率降低;
反应物的温度,在其他条件相同时,升高反应物的温度,化学反应速率加快;降低反应物的温度,反应速率降低.
解答:
解:(1)实验2和3以及2和4硫酸浓度相同同,固体的表面积不同,可用于比较固体表面积对反应速率的影响,故答案为:固体反应物的表面积;表面积越大;
(2)比较4、5实验数据,固体表面积、硫酸浓度相同,但4反应速率较慢,应为温度的影响,故答案为:20;
(3)仅表明反应物浓度对反应速率产生影响,则反应的温度、固体的表面积应相同,则应为1、2、4的实验,故答案为:1、2、4;
(4)本实验探究浓度、温度、固体表面积等影响,其中4和5可比较温度的影响,故答案为:反应温度;4和5.
(2)比较4、5实验数据,固体表面积、硫酸浓度相同,但4反应速率较慢,应为温度的影响,故答案为:20;
(3)仅表明反应物浓度对反应速率产生影响,则反应的温度、固体的表面积应相同,则应为1、2、4的实验,故答案为:1、2、4;
(4)本实验探究浓度、温度、固体表面积等影响,其中4和5可比较温度的影响,故答案为:反应温度;4和5.
点评:本题考查影响化学反应速率的因素的探究,侧重于学生的分析能力和实验能力的考查,为高频考点,注意对比表中数据,把握影响反应速率的因素,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
化学与环境、科学、技术密切相关.下列有关说法中正确的是( )
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、在海轮外壳上镶入锡块,可减缓船体的腐蚀速率 |
| C、光化学烟雾的形成与汽车尾气中的氮氧化物有关 |
| D、“鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
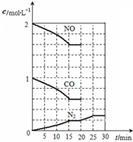 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
 生成铝的产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.请回答下列问题:
生成铝的产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.请回答下列问题: