题目内容
5.某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g)$→_{△}^{催化剂}$2SO3(g);△H<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )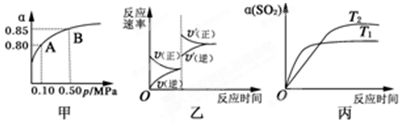
| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
分析 A.B点转化率为0.85,则平衡时浓度为$\frac{2mol×0.15}{10L}$;
B.A点转化率为0.8,则
2SO2(g)+O2(g)$→_{△}^{催化剂}$2SO3(g)
开始 0.2 0.1 0
转化 0.16 0.08 0.16
平衡 0.04 0.02 0.16
K=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.02}$;
C.达平衡后,若增大容器容积,反应速率减小,平衡逆向移动;
D.T1先达到平衡.
解答 解:A.B点转化率为0.85,则平衡时浓度为$\frac{2mol×0.15}{10L}$=0.03mol/L,故A错误;
B.A点转化率为0.8,则
2SO2(g)+O2(g)$→_{△}^{催化剂}$2SO3(g)
开始 0.2 0.1 0
转化 0.16 0.08 0.16
平衡 0.04 0.02 0.16
K=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.02}$=800(L•mol-1),故B正确;
C.达平衡后,若增大容器容积,反应速率减小,平衡逆向移动,且逆反应速率大于正反应速率,与图象不符,故C错误;
D.T1先达到平衡,则T1>T2,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K的计算及平衡移动为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.

| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y的氧化物是酸性氧化物 |
| A. | 能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42- | |
| B. | 水电离出来的 c(H+)=10-13mol•L-1的溶液:NH4+、Fe2+、NO3-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:K+、Fe3+、Cl-、SO42- | |
| D. | 加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42- |
| A. | 标准状况下,22.4 L Cl2与足量水反应,转移的电子数目等于NA | |
| B. | 17 g-18OH所含的电子数目为9NA | |
| C. | 16 g N2 H4中含有的非极性共价键数目为0.5NA | |
| D. | 常温时,1 L pH=12的 Ba(OH)2溶液中含OH一的数目为2×10-2NA |
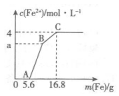 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )| A. | 原溶液的c(H+)=4 mol•L-1 | |
| B. | 若a=3,则原溶液中c(Cu2+)=1 mol•L-1 | |
| C. | 原溶液中的c(NO3)=7 mol•L-1 | |
| D. | BC段发生反应的离子方程式为Cu2++Fe═Fe2++Cu |
| 选项 | 物质(括号内为杂质) | 实验方法 |
| A | K2SO4 (K2CO3) | 加入稀硫酸使溶液呈中性 |
| B | NaCl (KNO3) | 样品配制成热饱和溶液,冷却结晶,过滤 |
| C | CO2(HCl) | 通过NaHCO3饱和溶液,干燥 |
| D | 溴苯(溴) | 加入足量NaOH溶液,充分振荡,分液 |
| A. | A | B. | B | C. | C | D. | D |
 二氧化硫在生产和生活中有重要的应用.
二氧化硫在生产和生活中有重要的应用. S+2CO2.
S+2CO2.