题目内容
15.某矿石由前20号元素中的4种组成,其化学式为WYZX4.X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体.下列说法正确的是( )| A. | 原子半径:W>Y>Z>X | |
| B. | 气态氢化物的稳定性:X<Z | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y的氧化物是酸性氧化物 |
分析 X、Y、Z、W分布在三个周期,为前20号元素,原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,X原子只能有2个电子层,最外层电子数为6,则X为O元素;Z单质是一种良好的半导体,应为Si元素;Y、Z位于同一周期,结合原子序数可知,Y最外层电子数小于4,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,故Y最外层电子数-W最外层电子数=6-4=2,W、Y为金属元素,则Y的最外层电子数为3,W的最外层电子数为1,故Y为Al元素,W原子序数大于硅元素,故W为K元素,钾能与冷水剧烈反应,可知矿石化学式为KAlSiO4,以此来解答.
解答 解:由上述分析可知,X为O,Y为Al,Z为Si,W为K,
A.同主族自上而下原子半径越大,同周期元素从左到右原子半径逐渐减小,可知原子半径W(K)>Y(Al)>Z(Si)>X(O),故A正确;
B.元素的非金属性越强,对应的氢化物越稳定,非金属性X(O)>Z(Si),则气态氢化物的稳定性:X>Z,故B错误;
C.金属性越强,对应最高价氧化物对应水化物碱性越强,则碱性W>Y,故C错误;
D.Y的氧化物为氧化铝,氧化铝具有两性,与酸碱均反应生成盐和水,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,根据Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等推断元素原子的最外层电子数是关键,侧重分析与应用能力的考查,注意周期律的应用,题目难度不大.

练习册系列答案
相关题目
5.一定温度下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,溶液pH变化的曲线如图所示.下列叙述中正确的是( )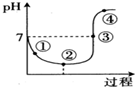

| A. | 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| B. | 点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) | |
| C. | 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
6.下列说法错误的是( )
| A. | 纯铁比生铁更耐腐蚀 | |
| B. | 明矾水解形成胶体能吸附悬浮物,可用于净水 | |
| C. | 碳酸钠溶液呈碱性是因为其在水中电离出OH- | |
| D. | 工业废水中的Cu2+和Hg2+可用Na2S或H2S除去 |
3.下列说法摘自某些刊物,你认为无科学性错误的是( )
| A. | 铅笔芯的原料是铅,儿童用嘴咬铅笔会导致铅中毒 | |
| B. | 在生有煤炉的居室里放一盆水,可以防止CO中毒 | |
| C. | 在农作物温室大棚内燃烧煤,产生的CO2不利于植物的生长 | |
| D. | 高纯硅应用在半导体元件与集成芯片之中,所以说“硅是信息技术革命的催化剂” |
10.下列化工生产过程中,未涉及氧化还原反应的是( )
| A. | 侯式制碱法制纯碱 | B. | 海带提碘 | ||
| C. | 电解饱和食盐水制烧碱 | D. | 工业上合成氨 |
20.下列分离或提纯物质的方法正确的是( )
| A. | 用溶解、过滤的方法提纯含有少量 BaSO4 的 BaCO3 | |
| B. | 用过滤的方法除去 NaCl 溶液中含有的少量淀粉胶体 | |
| C. | 用渗析的方法精制 Fe(OH)3 胶体 | |
| D. | 用分液的方法分离水和酒精 |
7. 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管 A 中应加入的试剂是普通铁粉 | |
| B. | 烧瓶 B 的作用是防止倒吸,烧瓶 C 的作用是产生水蒸气 | |
| C. | 试管 D 中收集得到的是 H2 | |
| D. | 3 mol 单质 Fe 全部转变为 Fe3O4,失去 8 mol 电子 |
4.下列叙述正确的是( )
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 |
5.某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g)$→_{△}^{催化剂}$2SO3(g);△H<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )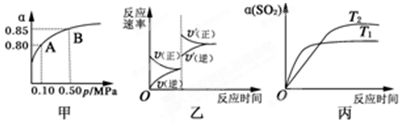

| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |