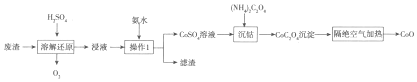
题目内容
17.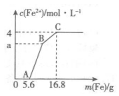 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )| A. | 原溶液的c(H+)=4 mol•L-1 | |
| B. | 若a=3,则原溶液中c(Cu2+)=1 mol•L-1 | |
| C. | 原溶液中的c(NO3)=7 mol•L-1 | |
| D. | BC段发生反应的离子方程式为Cu2++Fe═Fe2++Cu |
分析 OA段无Fe2+生成,是加入的5.6g即0.1mol铁粉与硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,根据消耗的铁的物质的量求出溶液中的氢离子的物质的量;
AB段,加入的铁粉和溶液中的Fe3+反应:2Fe3++Fe=3Fe2+;
BC段,加入的铁粉和Cu2+反应:Fe+Cu2+=Cu+Fe2+.据此分析.
解答 解:A、OA段无Fe2+生成,是加入的5.6g即0.1mol铁粉与硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O,设溶液中的氢离子的物质的量为xmol,则有:
Fe+4H++NO3-=Fe3++NO↑+2H2O
1 4
0.1mol xmol
则有:$\frac{1}{0.1mol}=\frac{4}{xmol}$
解得x=0.4mol 则溶液中的氢离子的物质的量浓度c=$\frac{0.4mol}{0.1L}$=4mol/L,故A正确;
B、若a=3,则说明在BC段生成的Fe2+的物质的量为n=0.1mol,而BC段发生的反应为Fe+Cu2+=Cu+Fe2+,设溶液中的Cu2+的物质的量为ymol,则有:
Fe+Cu2+=Cu+Fe2+
1 1
ymol 0.1mol
则有:$\frac{1}{ymol}=\frac{1}{0.1mol}$
则有:y=0.1mol,则溶液中的铜离子的物质的量浓度c=$\frac{0.1mol}{0.1L}$=1mol/L,故B正确;
C、C点溶液中c(Fe2+)=4mol/L,故此时溶液中的n(Fe2+)=CV=4mol/L×0.1L=0.4mol,而此时溶液中溶质为Fe(NO3)2,故C点溶液中的n(NO3-)=0.8mol,而在OA段加入0.1mol铁反应时,消耗掉的硝酸根为0.1mol,故原溶液中的n(NO3-)总=0.8mol+0.1mol=0.9mol,故浓度为c(NO3-)总=$\frac{0.9mol}{0.1L}$=9mol/L,故C错误;
D、BC段,加入的铁粉和Cu2+反应:Fe+Cu2+=Cu+Fe2+,故D正确.
故选C.
点评 本题考查了向混合溶液中加入铁粉的反应的先后顺序以及有关计算,综合性较强,应注意不同阶段的反应实质.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管 A 中应加入的试剂是普通铁粉 | |
| B. | 烧瓶 B 的作用是防止倒吸,烧瓶 C 的作用是产生水蒸气 | |
| C. | 试管 D 中收集得到的是 H2 | |
| D. | 3 mol 单质 Fe 全部转变为 Fe3O4,失去 8 mol 电子 |
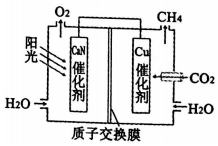
| A. | 该装置是原电池 | |
| B. | GaN催化剂表面发生氧化反应,溶液酸性增强 | |
| C. | 电子从GaN催化剂经导线转移到Cu催化剂 | |
| D. | Cu催化剂表面的反应是CO2+8H++8e-=CH4+2H2O |
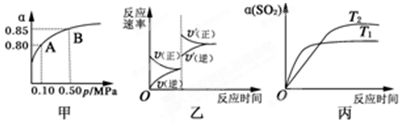
| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
| A. | 常温下,0.l mol•L-1CH3COOH溶液的pH=3,则CH3COOH的电离平衡常数约为10-5 | |
| B. | 常温下,pH=7的溶液中,K+、NH4+、NO3-、CH3COO-能大量共存 | |
| C. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu | |
| D. | 向Fe(OH)3胶体中逐滴加入盐酸,可观察到先生成红褐色沉淀,后沉淀溶解 |
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3OOCCH3甲酸乙酯 | ||
| C. |  硬脂酸甘油脂 硬脂酸甘油脂 | D. |  3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
(1)测得实验数据时,反应不是(填“是”或“不是”)处于平衡状态.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD
A.使用催化剂A B.使用催化剂B C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明:在相同温度下,因为催化剂A和B对反应Ⅰ的催化能力不同,所以在该时刻不同的催化剂对CO2转化成CH3OH的选择性有显著的影响.
| A. | 常温下,pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| B. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液中:NH4+、Mg2+、SO42- |