题目内容
19.将4.3g Na、Na2O2、Na2O的混合物与足量水反应,在标准状况下得到672mL混合气体,将气体在密闭容器中放电后冷却到标准状况下,发现容器内压强接近于零,则原混合物中Na、O元素的物之比为( )| A. | 1:1 | B. | 1:2 | C. | 4:3 | D. | 2:1 |
分析 Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,然后得出Na与过氧化钠组成的混合物中Na、O元素的物质的量之比,根据计算结果进行判断.
解答 解:钠与水、过氧化钠与水、氢气与氧气的反应方程式如下:
2Na+2H2O=2NaOH+H2↑ 钠与氢气的关系式为2Na~H2
2Na2O2+2H2O=4NaOH+O2↑ 过氧化钠与氧气的关系式为 2Na2O2~O2
2H2+O2$\frac{\underline{\;放电\;}}{\;}$2H2O 氢气和氧气的关系式为2H2~O2
将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,
通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na~2H2~O2~2Na2O2
所以钠与过氧化钠的物质的量之比=4:2=2:1,Na与O元素的物质的量之比=(2+1×2):(1×2)=2:1,而Na2O中Na、O原子的物质的量之比也是2:1,
所以该混合物中Na、O元素的物之比为2:1,
故选D.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,如果采用常规做法,计算量较大,应用公式次数较多,较容易出错,如果抓住关键字采用关系式进行分析m化繁为简,效果较好.

练习册系列答案
相关题目
5.某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g)$→_{△}^{催化剂}$2SO3(g);△H<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )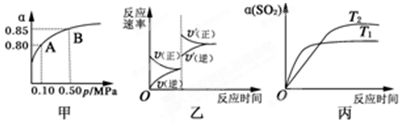

| A. | 由图甲推断,B点SO2的平衡浓度为0.3 mol•L-1 | |
| B. | 由图甲推断,A点对应温度下该反应的平衡常数为800(L•mol-1) | |
| C. | 达平衡后,若增大容器容积,则反应速率变化图象可以用图乙表示 | |
| D. | 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
10.在相同压强下,经过相同反应时间测得如下实验数据:
【备注】甲醇选择性:转化的CO2中生成甲醇的百分比.
(1)测得实验数据时,反应不是(填“是”或“不是”)处于平衡状态.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD
A.使用催化剂A B.使用催化剂B C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明:在相同温度下,因为催化剂A和B对反应Ⅰ的催化能力不同,所以在该时刻不同的催化剂对CO2转化成CH3OH的选择性有显著的影响.
| 实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 1 | 543 | 催化剂A | 12.3 | 42.3 |
| 2 | 543 | 催化剂B | 10.9 | 72.7 |
| 3 | 553 | 催化剂A | 15.3 | 39.1 |
| 4 | 553 | 催化剂B | 12.0 | 71.6 |
(1)测得实验数据时,反应不是(填“是”或“不是”)处于平衡状态.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD
A.使用催化剂A B.使用催化剂B C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明:在相同温度下,因为催化剂A和B对反应Ⅰ的催化能力不同,所以在该时刻不同的催化剂对CO2转化成CH3OH的选择性有显著的影响.
14.X、Y、Z、W四种短周期元素,其中Z是金属元素,且原子序数依次增大,下列说法正确的是( )
| 元素 | 有关性质及结构信息 |
| X | 所有已知晶体中硬度最大 |
| Y | Y原子的最高价氧化物和气态氢化物能化合成一种盐 |
| Z | 其氢氧化物溶于强碱溶液但不溶于水 |
| W | 其单质常存在于火山喷口处 |
| A. | Y、Z形成的简单离子半径大小关系是Y<Z | |
| B. | H-W键与H-Y键键能较大的是H-W键 | |
| C. | XW2可清洗附着在试管内壁的硫 | |
| D. | Z2W3不能与水反应 |
11.常温下,下列各组离子能大量共存的是( )
| A. | 常温下,pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| B. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液中:NH4+、Mg2+、SO42- |
8.pC类似pH,是指稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol•L-1,则该溶液中溶质的pC=3.下列叙述正确的是( )
| A. | 常温下,0.01mol•L-1的醋酸溶液中,pC(H+)=2 | |
| B. | 常温下,向0.01mol•L-1的氨水中加入等体积等浓度的盐酸,混合液的pC(H+)<7 | |
| C. | 100℃时,0.01mol•L-1的NaOH溶液中,pC(OH-)+pC(H+)=14 | |
| D. | 100℃时,CaCO3的Ksp=2.5×10-9,其饱和溶液中pC(Ca2+)+pC(CO32-)=9 |
9.下列离子方程式书写正确的是( )
| A. | AlCl3溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量的澄清石灰水与碳酸氢钠溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| C. | 硫酸与Ba(OH)2溶液反应:H++OH-=H2O | |
| D. | FeCl3溶液与Fe反应:Fe3++Fe=2Fe2+ |