题目内容
18.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)?3Z(g),平衡时,X、Y、Z的分别为30%、60%、10%.在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.请回答:
(1)m的值为2.
(2)X与Y的平衡转化率之比为1:1.
(3)第二次平衡时,Z的浓度为0.2mol/L.
分析 (1)此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变,可知该反应为气体体积不变的反应;
(2)X、Y的起始量之比为1:2,平衡时,X、Y的分别为30%、60%,仍为1:2,且转化量等于化学计量数之比;
(3)第二次平衡时Z的物质的量为(3mol+1mol)×10%=0.4mol,结合c=$\frac{n}{V}$计算.
解答 解:(1)此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变,可知该反应为气体体积不变的反应,则1+m=3,可知m=2,
故答案为:2;
(2)X、Y的起始量之比为1:2,平衡时,X、Y的分别为30%、60%,仍为1:2,且转化量等于化学计量数之比,均为1:2,则X、Y的转化率之比为1:1,
故答案为:1:1;
(3)由m=2可知,再加Z时二者平衡等效,体积分数不变,则第二次平衡时Z的物质的量为(3mol+1mol)×10%=0.4mol,Z的浓度为$\frac{0.4mol}{2L}$=0.2mol/L,
故答案为:0.2mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握二者为等效平衡判定m=2为解答的关键,侧重分析与应用能力的考查,注意转化率的判断与起始量、化学计量数的关系,题目难度不大.

练习册系列答案
相关题目
3.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素 2812Mg,该同位素的原子核内的中子数是( )
| A. | 12 | B. | 14 | C. | 16 | D. | 18 |
10.常温下,体积相同、物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液pH分别为7、9、10,则下列说法不正确的是( )
| A. | 酸性强弱HX>HY>HZ | B. | 有两种盐能发生水解 | ||
| C. | 分别稀释上述三种溶液,pH均变小 | D. | 三种溶液中离子总数不相同 |
8.向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
| A. | KI和NaBr | B. | KCl和NaCl | C. | KCl和NaBr | D. | KCl、NaCl和I2 |
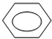 +HO-NO2→
+HO-NO2→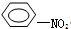 +H2O.
+H2O.
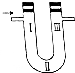 ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).