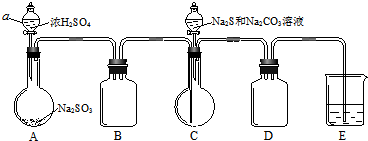
题目内容
6. ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).
ClO2作为一种广谱型的消毒剂,其有效氯是氯气的2.6倍.如图是实验室用于制备ClO2并检验其部分性质的装置(某些夹持装置省略).已知:①ClO2是一种易溶于水、难溶于有机溶剂的气体;
②实验室制备ClO2的原理:2NaClO2+Cl2═2ClO2+2NaCl.
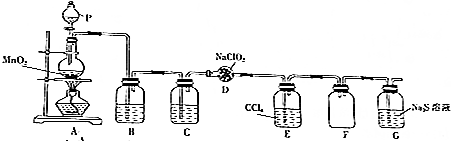
(1)仪器P的名称是分液漏斗.
(2)写出装置A中烧瓶内发生反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)F的作用是防止倒吸,E装置中所盛试剂的作用是除去ClO2中的未反应的Cl2.
(4)反应结束后,取G中溶液分别滴入AgNO3溶液和BaCl2溶液中,均产生不溶于稀硝酸的沉淀,则G中反应的离子方程式为8ClO2+5S2-+4H2O=5SO42-+8H++8Cl-.
(5)漂白性验证.将装置G换成如图装置,该装置中Ⅰ、Ⅱ、Ⅲ位置依次放入的是bea(填字母).
a.干燥的有色布条 b.湿润的有色布条 c.浓硫酸 d.碱石灰 e.无水氯化钙.
分析 由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,经装置B中饱和食盐水吸收氯化氢除杂、通过装置C中的浓硫酸干燥后,在D中与亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,ClO2是一种易溶于水、难溶于有机溶剂的气体,E用于除去ClO2中的未反应的Cl2,F装置是安全瓶防止G中溶液倒吸,最后尾气吸收,
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2;
(3)F为安全瓶防止倒吸;由于Cl2易溶于CCl4液体,ClO2是一种易溶于水、难溶于有机溶剂的气体,E用于除去ClO2中的未反应的Cl2;
(4)反应结束后,取G中溶液分别滴入AgNO3溶液和BaCl2溶液中,均产生不溶于稀硝酸的沉淀,说明生成产物中含有氯离子、硫酸根离子,结合原子守恒、电子守恒、电荷守恒配平书写离子方程式;
(5)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性.
解答 解:(1)装置中仪器图形分析可知P为分液漏斗,故答案为:分液漏斗;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)F导气管略露出胶塞为安全瓶防止倒吸;由于Cl2易溶于CCl4液体,ClO2是一种易溶于水、难溶于有机溶剂的气体,E用于除去ClO2中的未反应的Cl2,
故答案为:防止倒吸;除去ClO2中的未反应的Cl2;
(4)反应结束后,取G中溶液分别滴入AgNO3溶液和BaCl2溶液中,均产生不溶于稀硝酸的沉淀,说明生成产物中含有氯离子、硫酸根离子,结合原子守恒、电子守恒、电荷守恒配平书写离子方程式为:8ClO2+5S2-+4H2O=5SO42-+8H++8Cl-,
故答案为:8ClO2+5S2-+4H2O=5SO42-+8H++8Cl-;
(5)装置G的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,干燥氯气的试剂不能选液体,选择固体干燥剂,碱石灰会反应,所以选无水氯化钙,Ⅰ、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,
故答案为:bea.
点评 本题考查了实验室制备氯气装置、除杂、气体性质和实验验证,氧化还原反应分析等知识点,掌握基础是解题关键,题目难度中等.

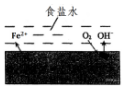 在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )
在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现.铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图.下列说法正确的是( )| A. | 铁片发生还原反应而被腐蚀 | |
| B. | 此过程中电子从C移向Fe | |
| C. | 铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-═4OH- | |
| D. | 铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀 |
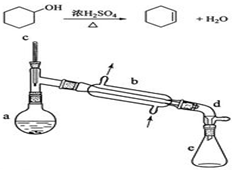 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:可能用到的有关数据如表:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检查是否漏液;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是c(填正确答案标号).
A.41% B.50% C.61% D.70%
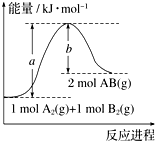 图象法是研究化学反应的焓变的一种常用方法.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是( )
图象法是研究化学反应的焓变的一种常用方法.已知化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是( )| A. | 每生成2 mol AB时吸收(a-b) kJ能量 | |
| B. | 该反应热△H=+(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键时放出a kJ能量 |
| A. | 用可见光束可以鉴别红褐色的氢氧化铁胶体和溴水,是因为溶液与胶体的本质区别是能否发生丁达尔效应 | |
| B. | 分散系是一种物质分散到另一种物质中形成的混合体系 | |
| C. | 氢氧化铁胶体具有吸附性,能吸附水中悬浮颗粒并沉降,因而常用于净水 | |
| D. | 淀粉溶液和蛋白质溶液是溶液,不可能是胶体 |