题目内容
18.下表是五种短周期的原子半径及主要化合价.| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
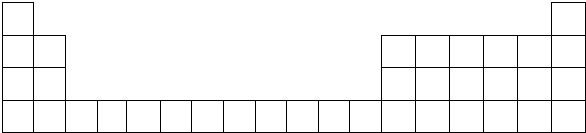
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
(2)B元素在元素周期表中的第三 周期IIIA 族;
(3)上述五种元素最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)A、D形成化合物的电子式
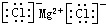 ;
;(5)C、E形成化合物为SO2或SO3(填化学式),含化学键类型为共价键(填“离子键”或“共价键”).
分析 (1)短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有+7、-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al;
(2)B为Al元素,结合周期表分析;
(3)元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
(4)A、D形成的化合物为氯化镁,是离子化合物;
(5)C为S,E为O,二者形成共价化合物.
解答 解:(1)短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有+7、-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al;它们在周期表中位置为:
| O | |||||||||||||||||
| Mg | Al | S | Cl | ||||||||||||||
故答案为:
| O | |||||||||||||||||
| Mg | Al | S | Cl | ||||||||||||||
(2)B为Al元素,在周期表中位于第三周期第IIIA族;
故答案为:三,ⅢA;
(3)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性:O>Cl>S,O没有最高价氧化物,所以最高价氧化物的水化物的酸性最强的是HClO4;
故答案为:HClO4;
(4)A、D形成的化合物为氯化镁,是离子化合物,其电子式为:
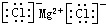 ;
;故答案为:
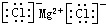 ;
;(5)C为S,E为O,二者形成共价化合物SO2或SO3,分子中只含有共价键;
故答案为:SO2或SO3;共价键.
点评 本题考查结构性质位置关系综合应用,根据原子半径与化合价推断元素是解题关键,注意对元素周期律的理解掌握,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
9.下列叙述正确的是( )
| A. | 离子晶体中,只存在离子键,不可能存在其他化学键 | |
| B. | 原子晶体中,只存在共价键;稀有气体的原子能形成分子晶体 | |
| C. | NaHSO4、NaOH晶体中的阴、阳离子个数比均为1:2 | |
| D. | 晶体熔点:金刚石>食盐>干冰>冰 |
6.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
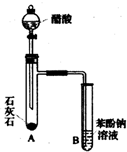
10.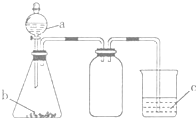 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
 利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )| 试剂a | 试剂b | 试剂c | 实验目的 | |
| ① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ |
| ② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 |
| ③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性: MnO2>C12>I2 |
| ④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |
7.下列递变情况中,不正确的是( )
| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
8.下列有机化合物命名正确的是( )
| A. | 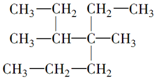 4-甲基-4,5-二乙基乙烷 4-甲基-4,5-二乙基乙烷 | B. | 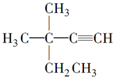 3,3-二甲基-1-戊炔 3,3-二甲基-1-戊炔 | ||
| C. | 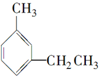 3-甲基乙基苯 3-甲基乙基苯 | D. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
 .
.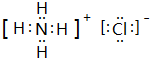 ,A2C2的电子式为
,A2C2的电子式为 .
. 有机化合物分子中的基团之间存在着相互影响.
有机化合物分子中的基团之间存在着相互影响.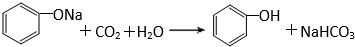 .
.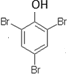 .
.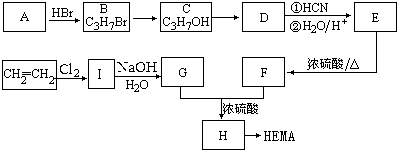
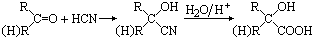
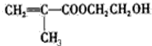 甲基丙烯酸羟乙酯
甲基丙烯酸羟乙酯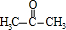 +2H2O.
+2H2O. .
.