题目内容
8.A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大.A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y,且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水.(1)F元素的名称是氯,B单质的化学式为N2.
(2)用电子式表示化合物X的形成过程
 .
.(3)化合物Y的电子式为
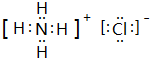 ,A2C2的电子式为
,A2C2的电子式为 .
.(4)D、F最高价氧化物的水化物之间反应的离子方程式为OH-+H+=H2O.
(5)D、E最高价氧化物的水化物之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,则A为H元素;A、D同主族,可形成离子化合物X,故D为Na,二者形成的离子化合物X为NaH;B的单质是空气中含量最高的物质,则B为N元素;C原子的最外层电子是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,故E为Al,3种原子最外层共有11个电子,则F原子最外层电子数为11-1-3=7,故F为Cl;B的氢化物与F的氢化物反应生成离子化合物Y为NH4Cl,据此解答.
解答 解:A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,则A为H元素;A、D同主族,原子序数相差大于2,故D为Na,二者形成的离子化合物X为NaH;B的单质是空气中含量最高的物质,则B为N元素;C原子的最外层电子是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,故E为Al,3种原子最外层共有11个电子,则F原子最外层电子数为11-1-3=7,故F为Cl;B的氢化物与F的氢化物反应生成离子化合物Y为NH4Cl.
(1)F元素的名称是:氯,B单质为N2,
故答案为:氮;N2;
(2)用电子式表示化合物NaH的形成过程为: ,
,
故答案为: ;
;
(3)化合物Y为NH4Cl,电子式为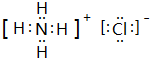 ,H2O2的电子式为
,H2O2的电子式为 ;
;
故答案为: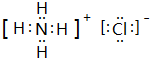 ;
; ;
;
(4)D、F最高价氧化物的水化物分别为NaOH、HClO4,二者反应生成高氯酸钠与水,反应离子方程式为:OH-+H+=H2O;
故答案为:OH-+H+=H2O;
(5)D、E最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查位置结构性质关系应用,题目难度中等,推断元素是解题关键,侧重对化学用语的考查,注意理解掌握用电子式表示化学键或物质的形成.

 阅读快车系列答案
阅读快车系列答案| A. | 利用蓝绿藻等低等生物和微生物在阳光作用下使水分解产生氢气,该方法符合绿色化学原则 | |
| B. | 12C、13C和14C互为同位素,它们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
探究浓度对化学反应速率的影响,应选择①②或①③或④⑤(填实验编号);
若同时选择①②③溶液变浑浊的时间,探究比较改变不同反应物浓度对反应速率的影响对化学反应速率的影响.
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.将体积比为1:2的CO2、H2气体置于密闭容器中发生上述反应,CO和H2O的体积比保持不变时.
| A. | 未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗 | |
| B. | 装待测液的锥形瓶用蒸馏水洗涤后,没用待测液冲洗 | |
| C. | 量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面 | |
| D. | 滴定开始滴定管尖端有气泡,到达终点时尖端无气泡 |
| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
(2)B元素在元素周期表中的第三 周期IIIA 族;
(3)上述五种元素最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)A、D形成化合物的电子式
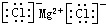 ;
;(5)C、E形成化合物为SO2或SO3(填化学式),含化学键类型为共价键(填“离子键”或“共价键”).