题目内容
7.下列递变情况中,不正确的是( )| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
分析 A.主族元素最外层电子数等于其族序数;
B.主族元素最高化合价与其族序数相等,但O、F元素除外;
C.同一周期元素,原子半径随着原子序数增大而减小;
D.同一主族元素,元素的金属性随着原子序数增大而增强.
解答 解:A.主族元素最外层电子数等于其族序数,Na、Mg、Al族序数分别是第IA族、第IIA族、第IIIA族,则Na、Mg、Al原子的最外层电子数依次增多,故A正确;
B.主族元素最高化合价与其族序数相等,但O、F元素除外,Si、P、S元素的最高正价依次为+4、+5、+6,故B正确;
C.同一周期元素,原子半径随着原子序数增大而减小,则C、N、O的原子半径依次减小,故C错误;
D.同一主族元素,元素的金属性随着原子序数增大而增强,所以金属性Li、Na、K依次增强,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系是解本题关键,知道非金属性、金属性强弱比较方法,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
17.对于4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g),试回答有关的问题:为了提高生成SO2的速率,可以采用的措施是( )
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
18.下表是五种短周期的原子半径及主要化合价.
已知铍的原子半径为0.089nm.
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
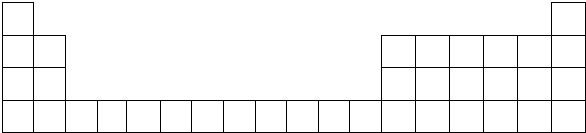
(2)B元素在元素周期表中的第三 周期IIIA 族;
(3)上述五种元素最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)A、D形成化合物的电子式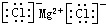 ;
;
(5)C、E形成化合物为SO2或SO3(填化学式),含化学键类型为共价键(填“离子键”或“共价键”).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).

(2)B元素在元素周期表中的第三 周期IIIA 族;
(3)上述五种元素最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)A、D形成化合物的电子式
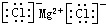 ;
;(5)C、E形成化合物为SO2或SO3(填化学式),含化学键类型为共价键(填“离子键”或“共价键”).
2.某兴趣小组进行铁矿石中含铁量的测定,实验过程如图:

下列说法正确的是( )

下列说法正确的是( )
| A. | 加热煮沸的主要目的是除去溶液中溶解的氧气 | |
| B. | 稀释过程中用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管 | |
| C. | 滴定过程中可用淀粉溶液作指示剂 | |
| D. | 铁矿石中铁的质量分数为70% |
19.丁烷的一氯代物共有多少种( )
| A. | 3 | B. | 5 | C. | 4 | D. | 2 |
16.下列实验能获得成功的是( )
| A. | 用酸性高锰酸钾溶液鉴别乙烷和乙烯 | |
| B. | 用分液漏斗分离乙醛和水 | |
| C. | 用苯、溴水和铁粉混合制取溴苯 | |
| D. | 用紫色石蕊溶液检验苯酚弱酸性 |
17.下列关于蛋白质的说法中不正确的是( )
| A. | 蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命 | |
| B. | HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性 | |
| C. | 某些蛋白质跟浓硝酸作用会变黄 | |
| D. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 |
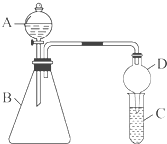 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.