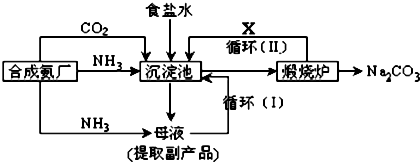
题目内容
2.在一个容积为2L的密闭容器中加入2molN2和6molH2,发生如下反应N2(g)+3H2(g)=2NH3(g)△H<0,5min后平衡测得c(NH)3=0.5mol/L(1)该条件下此反应的化学平衡常数的表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$.温度升高,则K值变小.(填“变大”、“变小”或“不变”)
(2)若平衡时,移走1molN2和3molH2,在相同温度下再达平衡时c(NH3)<0.25mol/L.(填“>”、“<”或“=”)
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比,△H<0,升高温度,平衡逆向移动;
(2)移走1molN2和3molH2,若平衡不移动,c(NH3)=0.25mol/L,但体积、温度不变时,物质的量减小,压强减小,平衡逆向移动.
解答 解:(1)K为生成物浓度幂之积与反应物浓度幂之积的比,K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;△H<0,升高温度,平衡逆向移动,则K变小,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;变小;
(2)平衡测得c(NH)3=0.5mol/L,移走1molN2和3molH2,若平衡不移动,c(NH3)=0.25mol/L,但体积、温度不变时,物质的量减小,压强减小,平衡逆向移动,则再达平衡时c(NH3)<0.25mol/L,
故答案为:<.
点评 本题考查化学平衡常数,为高频考点,把握K的意义及影响因素、平衡移动为解答的关键,侧重分析与应用能力的考查,注意(2)中压强对平衡的影响,题目难度不大.

练习册系列答案
相关题目
15.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应中属于区域3的是( )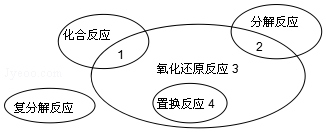

| A. | 2K2O2+2CO2═2K2CO3+O2 | B. | Cl2+2KBr═Br2+2KCl | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2NaHCO3═Na2CO3+H2O+CO2↑ |
17.下列说法正确的是( )
| A. | 两种难溶电解质作比较时,Ksp小的,溶解能力一定小 | |
| B. | 欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好 | |
| C. | 所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽 | |
| D. | 若已知Ksp(CaCO3)<Ksp(CaC2O4),欲使Ca2+沉淀最完全,选择Na2CO3作沉淀剂效果比Na2C2O4好 |
7.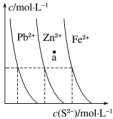 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.下列说法正确的是( )| A. | 三种难溶物的溶度积Ksp(FeS)的最小 | |
| B. | 如果向三种沉淀中加盐酸,最先溶解的是PbS | |
| C. | 向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀 | |
| D. | 对于三种难溶物来讲,a点对应的都是不饱和溶液 |
14.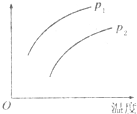 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
11.实验室配制80mL 1mol/L硫酸铜溶液,正确的操作是( )
| A. | 称量12.8gCuSO4溶解在100mL水中 | |
| B. | 称量25.0gCuSO4•5H2O晶体溶于100mL水中 | |
| C. | 称量16.0gCuSO4溶于水,然后稀释至100mL | |
| D. | 称量20.0gCuSO4•5H2O晶体溶于水,然后稀释至100mL |
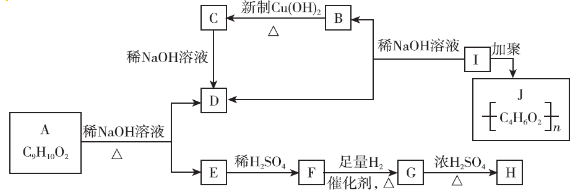
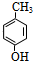 .
.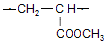 .
.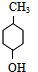 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.